(2010?普陀区二模)硫酸亚铁铵的化学式为(NH
4)
2SO
4?FeSO
4?6H
2O,商品名为莫尔盐,可由硫酸亚铁与硫酸铵反应生成.一般硫酸亚铁盐在空气中易被氧化,而形成莫尔盐后就比较稳定了.三种盐的溶解度(单位为g/100g水)如下表:
| 温度/℃ |
10 |
20 |
30 |
| (NH4)2SO4 |
73.0 |
75.4 |
78.0 |
| FeSO4?7H2O |
20.0 |
26.5 |
32.9 |
| (NH4)2SO4?FeSO4 |
17.2 |
21.6 |
28.1 |
(一)实验室制取少量莫尔盐的流程如图:

试回答下列问题:
(1)步骤1中加入10% Na
2CO
3溶液的主要作用是
除铁屑表面的油污
除铁屑表面的油污
;反应中铁屑过量是为了
还原氧化生成的Fe3+,保证Fe2+稳定、纯净地存在,减少产物中的Fe3+杂质
还原氧化生成的Fe3+,保证Fe2+稳定、纯净地存在,减少产物中的Fe3+杂质
.
(2)步骤3需要趁热过滤,原因是
FeSO4在温度低时溶解度较小,如果不趁热过滤就会有FeSO4?7H2O析出
FeSO4在温度低时溶解度较小,如果不趁热过滤就会有FeSO4?7H2O析出
.
(3)从步骤4到莫尔盐,必须进行的操作依次是
过滤、洗涤
过滤、洗涤
,析出的晶体常用
无水酒精或冰水
无水酒精或冰水
洗涤.
(4)若莫尔盐的饱和溶液中有水20克,当温度从30℃降至10℃,最多析出莫尔盐的质量是
B
B
(选填编号).
A.2.18g B.大于2.18g C.小于 2.18g D.无法确定
(二)称取质量为1.96g的莫尔盐制成溶液.用未知浓度的酸性KMnO
4溶液进行滴定.
(1)已知MnO
4-被还原为Mn
2+,试写出该滴定反应的离子方程式
5Fe2++MnO4-+8H+→5Fe3++Mn2++4H2O
5Fe2++MnO4-+8H+→5Fe3++Mn2++4H2O
.
(2)判断该反应到达滴定终点的现象为
加入最后一滴KMnO4溶液紫红色不褪,且半分钟内不褪色
加入最后一滴KMnO4溶液紫红色不褪,且半分钟内不褪色
.
(3)假设到达滴定终点时,用去VmL酸性KMnO
4溶液,则该酸性KMnO
4溶液的浓度为
mol/L.

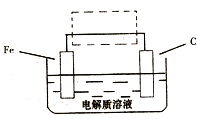 (2010?临沂一模)Fe元素是地壳中最丰富的元素之一,在金属中仅次于铝,铁及其化合物在生活、生产中有广泛应用.请回答下列问题:
(2010?临沂一模)Fe元素是地壳中最丰富的元素之一,在金属中仅次于铝,铁及其化合物在生活、生产中有广泛应用.请回答下列问题:


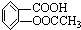 (相对分子质量为180).
(相对分子质量为180).
