
题目列表(包括答案和解析)
由实验得知,用电解法将电解液中的金属离子还原为金属单质时,电路中所通过的电量Q正比于金属的物质的量n和金属离子的化合价a的乘积,其比例系数F是一个恒量,称为法拉第常数,它与金属的种类无关.
(阿伏加德罗常数NA=6.02×1023mol-1,电子电量e=1.60×10-19C,Al的摩尔质量为27×10-3kg·mol-1)
(1)试求出法拉第常数F(电量以库仑为单位,保留三位有效数字).
(2)如果电解Al2O3获得1kg的金属铝,通过电解槽的电量是多少?
由实验得知,用电解法将电解液中的金属离子还原为金属单质时,电极所通过的电量Q正比于金属的物质的量n和金属离子化合价a的乘积,其比例系数F是一个恒量,称为法拉第常数,它与金属的种类无关。阿伏加德罗常数:NA=6.02´1023mol-1,电子电量:e=1.60´10-19C,Cu的摩尔质量:64´10-3kg/mol。(1)试求出法拉第常数F(电量以库仑为单位,保留三位有效数字)。(2)如果电解硫酸铜溶液获得1kg的金属铜,通过电解槽的电量是多少?(3)用电镀的方法在半径为R的铜壳表面上均匀镀上很薄的银层,在电解槽中铜球是阳极还是阴极?另一电极是什么材料?(4)若电流强度为I,通电时间为t,银的相对原子质量为A,金属银的密度为r,求镀层的厚度d(用题中的符号表示)。
类比是化学学习中常用的方法之一,已知硝酸能把铁氧化成 Fe ( NO3)3,但当铁过量时,产物是 Fe (NO3) 2 。某同学受此启发,提出一个相似的观点:氯气与铁粉反应,当 C12 足量时生成 FeC13 , 当铁粉过量时产物是 FeCl2 。为验证该观点是否正确,该同学将一根细的纯铁丝分别在足量和少量的 C12 中点燃,取其表面生成物并分别编号为 A、B ,然后通过实验确定其成分。
探究过程如下:
提出假设: A 是 FeCl3 , B 是 FeCl2 。
(1) 设计实验方案:分别取 A、B 的溶液均进行以下实验,但实验现象相同。请填写下表中的相应空格。
| 实验方法 | 实验现象 | 结论 |
| 分别向A、B溶液中加KSCN溶液 | ____________________ | 固体物质中有FeCl3 |
| 分别向KMnO4溶液中加适量A、B溶液 | KMnO4溶液颜色无明显变化 | 固体物质中不含_______ |
(2)根据上述实验结论,写出C12与铁粉加热时发生反应的化学方程式:
____________________________________________________________。
(3)为进一步探究 FeC13 溶液的性质,他又利用 A 溶液做了如下一些实验,其中明显错误的是_______________(填写序号)。
A.将 A 溶液滴入淀粉碘化钾溶液中,可得到蓝色液体,该液体能产生丁达尔现象
B.向 A 溶液中加入少量铁粉,铁粉溶解,溶液颜色加深
C.在 A 溶液中滴加NaOH浓溶液,出现红褐色沉淀
D.将 A 溶液加热蒸干并灼烧,得到FeC13固体
(4)FeCl3溶液常作印刷电路铜板腐蚀剂,腐蚀后的废液中含有 FeC13、FeCl2、CuCl2,
某研究性学习小组的同学们设计了两种从废液中回收 Cu的方案:
方案1:向废液中加入过量的铁粉,充分反应后,过滤。在所得滤渣中加入足量的盐酸,充分反应后,再过滤即得到铜。
该方案中涉及的四种阳离子的氧化性由强到弱的顺序为:
方案2 :在废液中加入适量的盐酸调节溶液的 pH = 1 ,用铜和石墨作电极进行电解。当观察到阴极上有少量气泡产生时,即停止电解,这时要回收的 Cu 已全部析出。该方案中铜作_________极,该电极上所发生的电极反应为(若有多个电极反应,请按照反应发生的先后顺序全部写出)______________________________________________________________。
方案2 在电极上直接回收铜,操作上比方案 1 简便,但方案 2 也有不足之处,主要表现为:____________________________________
(18分)1.已知一般钾盐均为可溶性的强电解质。在某溶液中可发生下列反应: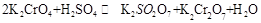
(1)试将上述反应改写成离子议程式
(2)该离子反应的平衡常数表达式为:K= ;
(3)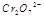 在水溶液中为红色,
在水溶液中为红色,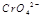 在水溶液中为黄色。某条件下该反应建立平衡后,体系为两种离子的混合液,颜色为橙色。
在水溶液中为黄色。某条件下该反应建立平衡后,体系为两种离子的混合液,颜色为橙色。
若加水将其稀释,溶液颜色将偏 (红、黄)原因是
;
若在在上述平衡体系的溶液中中加入硫酸钾固体体系颜色有何变化?为什么?
Ⅱ.固定和利用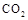 ,能有效地利用资源,并减少空气中的温室气体。工业上正在研究利用
,能有效地利用资源,并减少空气中的温室气体。工业上正在研究利用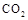 来生产甲醇燃料的方法,该方法的化学方程式是:
来生产甲醇燃料的方法,该方法的化学方程式是:
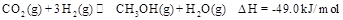
某科学实验将6mol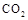 和8molH
和8molH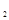 充入一容积为2L的密闭容器中,测得H
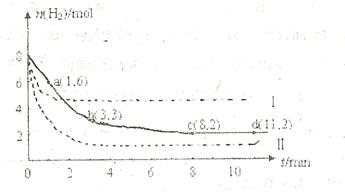
充入一容积为2L的密闭容器中,测得H 的物质的量随时间变化如右图中实线所示(图中字母后数字表示对应的坐标):
的物质的量随时间变化如右图中实线所示(图中字母后数字表示对应的坐标):
问题:
(1)由图分析,在下列时间段内反应速率最快的时间段是 (填答案编号)。
a.0~1min b.1~3min c.3~8min d.8~11min
(2)仅改变某一条件再进行实验,测得H 的物质的量随时间变化如图中虚线所示。与实线相比,曲线Ⅰ改变的条件可能是
,曲线Ⅱ改变的条件可能是
的物质的量随时间变化如图中虚线所示。与实线相比,曲线Ⅰ改变的条件可能是
,曲线Ⅱ改变的条件可能是
。
(3)下列表述能表示该反应已达平衡的是 (填答案编号)
a.容器内压强不再改变 b.容器内气体的密度不再改变
c.容器内气体平均摩尔质量不再改变 d.容器内各物质的物质的量相等
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com