
题目列表(包括答案和解析)
(14分)在450℃并有催化剂存在下,于一容积恒定的密闭容器内进行下列反应:
2SO2(g)+O2(g) 2SO3(g) △H=―190 kJ·mol—1
2SO3(g) △H=―190 kJ·mol—1
(1)该反应500℃时的平衡常数________450℃时的平衡常数(填“>”、“<”或“=”)。
(2)450℃时,在一2L密闭容器中,将二氧化硫和氧气混合,反应过程中SO2、O2、SO3物质的量变化如图,反应处于平衡状态的时间是 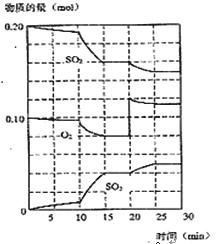
(3)据图判断,反应进行至20min时,曲线发生变化的原因是___________________(用文字表达),10min到15min的曲线变化的原因可能是 (填字母)。
| A.加了催化剂 | B.缩小容器体积 |
| C.降低温度 | D.增加SO3物质的量 |
(14分)在450℃并有催化剂存在下,于一容积恒定的密闭容器内进行下列反应:
2SO2(g)+O2(g)2SO3(g) △H=―190 kJ·mol—1
(1)该反应500℃时的平衡常数________450℃时的平衡常数(填“>”、“<”或“=”)。
(2)450℃时,在一2L密闭容器中,将二氧化硫和氧气混合,反应过程中SO2、O2、SO3物质的量变化如图,反应处于平衡状态的时间是
(3)据图判断,反应进行至20min时,曲线发生变化的原因是___________________(用文字表达),10min到15min的曲线变化的原因可能是 (填字母)。
A.加了催化剂 B.缩小容器体积
C.降低温度 D.增加SO3物质的量
(4)欲提高SO2的转化率,下列措施可行的是______。
(填字母)
a.向装置中再充入N2 b.向装置中再充入O2
c.改变反应的催化剂 d.升高温度
(5)利用图中数据计算450℃时反应进行至15min时,SO2的平衡转化率为: 。
(6)450℃时,另一2L容积不变的密闭容器中,测得某时刻各物质的量如下:
n(SO2)=0.4mol,n(O2)=0.2mol,n(SO3)=0.8mol,则此时该反应向 进行(填“向正反应方向”“向逆反应方向”或“处于平衡状态”)。
(14分)在450℃并有催化剂存在下,于一容积恒定的密闭容器内进行下列反应:
2SO2(g)+O2(g) 2SO3(g)
△H=―190 kJ·mol—1
2SO3(g)
△H=―190 kJ·mol—1
(1)该反应500℃时的平衡常数________450℃时的平衡常数(填“>”、“<”或“=”)。
(2)450℃时,在一2L密闭容器中,将二氧化硫和氧气混合,反应过程中SO2、O2、SO3物质的量变化如图,反应处于平衡状态的时间是
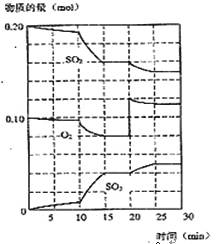
(3)据图判断,反应进行至20min时,曲线发生变化的原因是___________________(用文字表达),10min到15min的曲线变化的原因可能是 (填字母)。
A.加了催化剂 B.缩小容器体积
C.降低温度 D.增加SO3物质的量
(4)欲提高SO2的转化率,下列措施可行的是______。
(填字母)
a.向装置中再充入N2 b.向装置中再充入O2
c.改变反应的催化剂 d.升高温度
(5)利用图中数据计算450℃时反应进行至15min时,SO2的平衡转化率为: 。
(6)450℃时,另一2L容积不变的密闭容器中,测得某时刻各物质的量如下:
n(SO2)=0.4mol,n(O2)=0.2mol,n(SO3)=0.8mol,则此时该反应向 进行(填“向正反应方向”“向逆反应方向”或“处于平衡状态”)。
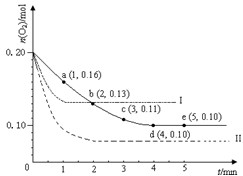 在一定温度下的2L密闭容器中充入0.4mol SO2和0.2mol O2,发生反应:2SO2(g)+O2(g)?2SO3(g)△H<0,n(O2)随时间的变化如图实线所示:
在一定温度下的2L密闭容器中充入0.4mol SO2和0.2mol O2,发生反应:2SO2(g)+O2(g)?2SO3(g)△H<0,n(O2)随时间的变化如图实线所示:在100℃时,将0.40molNO2气体充入2L密闭容器中,每隔一段时间对该容器的物质进行测量,得到的数据如下表:
|
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com