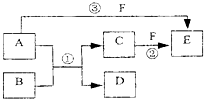
A、B、C、D、E、F六种物质的相互转化关系如下图所示(反应条件未标出),
其中反应①是置换反应,B、C、F都是气态单质,且B为黄绿色;反应③中有水生成,反应②需要放电才能发生,A和 D相遇有白烟生成.
(1)反应③的化学方程式为
;
(2)反应①中每生成1mol C,转移的电子数为
3.612×1024
3.612×1024
;
(3)A与D的水溶液恰好完全反应时,其生成物的水溶液呈
酸
酸
性(填“酸”“碱”或“中”),该水溶液中存在着如下关系,用粒子浓度符号填写:
①c(H
+)+
c(NH4+)
c(NH4+)
=c(OH
-)+
c(Cl-)
c(Cl-)
;
②c(H
+)=c(OH
-)+
c(NH3?H2O)
c(NH3?H2O)
.
(4)元素x与组成B的元素同周期,x的单质既可与酸反应也可与碱反应且都生成H
2,则
①X的单质与碱反应的离子方程式
2Al+2OH-+2H2O=2AlO2-+3H2↑
2Al+2OH-+2H2O=2AlO2-+3H2↑
;
②X、空气、海水可以组成新型海水标志灯的电池.该种灯以海水为电解质溶液,靠空气中的氧气使X不断氧化而源源不断产生电流,只要把灯放入海水中,数分钟后就会发出耀眼的闪光,其能量比干电池高20~50倍.则该新型电池的正极的电极反应式为
O2+H2O+4e-=4OH-
O2+H2O+4e-=4OH-
;原电池的总反应方程式为
4Al+3O2+6H2O=4Al(OH)3
4Al+3O2+6H2O=4Al(OH)3
.

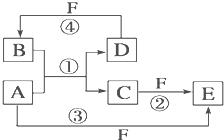 A、B、C、D、E、F六种物质的转化关系如图所示(反应条件和部分产物未标出).
A、B、C、D、E、F六种物质的转化关系如图所示(反应条件和部分产物未标出). A、B、C、D、E、F六种物质的相互转化关系如下图所示(反应条件未标出),
A、B、C、D、E、F六种物质的相互转化关系如下图所示(反应条件未标出),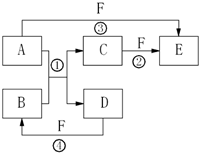 A、B、C、D、E、F六种物质的相互转化关系如图所示(反应条件及部分产物未列出)
A、B、C、D、E、F六种物质的相互转化关系如图所示(反应条件及部分产物未列出)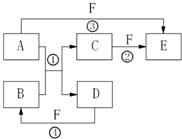 A、B、C、D、E、F六种物质的相互转化关系如右图所示(反应条件及部分产物未列出).
A、B、C、D、E、F六种物质的相互转化关系如右图所示(反应条件及部分产物未列出).

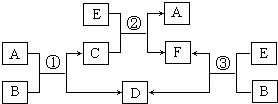 A、B、C、D、E、F六种物质在一定条件下有如图所示的相互转化关系,所有反应物和生成物均已给出.
A、B、C、D、E、F六种物质在一定条件下有如图所示的相互转化关系,所有反应物和生成物均已给出.