
题目列表(包括答案和解析)
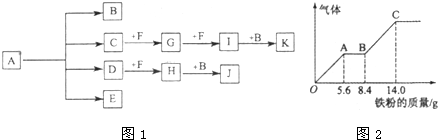
(13分)已知:正盐A强热可得到B、C、D、E四种物质,B通常情况下为无色无味液体,E、F 是空气主要成分,D能产生酸雨,I为红棕色气体,C与J反应可得A,J、K为两种常见的酸。物质之间的转化关系如图所示(图中部分反应物或生成物及反应条件未列出)。 
请回答下列问题:
(1)E物质的电子式是________。
(2)检验C的试纸是________,检验D的试剂是________(填试纸、试剂名称)。
(3)写出A强热分解生成B、C、D、E的化学方程式________。
(4)写出D通人FeCl3溶液时,发生反应的离子方程式_____ 。
(5) —定浓度J、K混合后的稀溶液200mL,平均分成两份。向其中一份中逐渐加人铜粉,最多能溶解a g(产生气体只为G)。向另一份中逐渐加人铁粉,产生气体的量随铁粉质量增加的变化如图所示。则①a=________g,②气体G标准状况下体积为________,③J的物质的量浓度为______。
工业上以黄铜矿为原料,采用火法熔炼工艺生产铜。
(1)该工艺的中间过程会发生反应:![]() ,反应的氧化剂是_____________________。
,反应的氧化剂是_____________________。
(2)尾气中的SO2经处理可得到有价值的化学品,写出其中1种酸和1种盐的名称
____________________________。
(3)黄铜矿熔炼后得到的粗铜含少量Fe、Zn、Ag、Au等金属杂质,需进一步采用电解法精制。在精炼铜时,阳极材料是________,阴极电极反应式是_____________________。
(4)在精炼铜的过程中,电解液中![]() 逐渐下降,
逐渐下降,![]() 、
、![]() 会逐渐增人,所以需定时除去其中的
会逐渐增人,所以需定时除去其中的![]() 、
、![]() 。下表为几种物质的溶度积。
。下表为几种物质的溶度积。
| 物质 |
|
|
|
|
| 溶度积 |
|
|
|
|
甲同学设计了如下除杂方案:
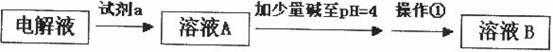
试剂a是__________,其目的是____________________________________;根据溶度积该方
案能够除去的杂质金属阳离子是____________。
乙同学在查阅资料时发现,“工业原料氯化铵中含杂质氯化铁,使其溶入水,再加入氨水
调节pH至7~8,可使![]() 生成
生成![]() 。沉淀而除去。”乙同学认为甲同学的方案中也
。沉淀而除去。”乙同学认为甲同学的方案中也
应该将溶液pH调至7~8。你认为乙同学的建议是否正确?________(填“是”或“否”),
理由是___________________________________________________________。
 氯气是氯碱工业的主要产品之一,是一种常用的消毒剂,其消毒原理是与水反应生成了次氯酸:
氯气是氯碱工业的主要产品之一,是一种常用的消毒剂,其消毒原理是与水反应生成了次氯酸:
| ||
| ||
(10分)氯气是氯碱工业的主要产品之一,它是一种常用的消毒剂,其消毒原理是与水反应生成了次氯酸:
Cl2 + H2O
 HCl
+ HClO K=4.5×10-4
HCl
+ HClO K=4.5×10-4
次氯酸的强氧化性能杀死水中的病菌(不直接用次氯酸为自来水消毒是因为次氯酸易分解,且毒性较大)。但是,由于氯气贮运不方便,且具有一定的危险性,目前正逐渐被其它性能优越的消毒产品所替代。请回答:
(1)氯碱工业生产氯气的化学方程式为 。
(2)84消毒液(主要成分为NaClO)与氯气相比具有贮运方便等优点,用氯气与烧碱溶液反应制备84消毒液的离子方程式为 。
(3)二氧化氯是一种高效、广谱、安全的杀菌、保鲜剂。我国科学家研发了用氯气氧化亚氯酸钠(NaClO2)固体制备二氧化氯的方法,其化学方程式为 。
(4)一位同学设计了一套用浓盐酸和KMnO4固体制取少量氯气并比较氯气与碘单质的氧
化性强弱的微型装置(如图)。

①下列溶液能吸收Cl2的是 (填字母序号)。
A. 饱和食盐水 B. 饱和Na2SO3溶液
C. 饱和NaOH溶液 D. 浓硫酸
②能说明Cl2的氧化性强于I2的实验现象是 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com