
题目列表(包括答案和解析)
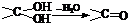 .
. 与NaOH的水溶液共热的化学方程式为:
与NaOH的水溶液共热的化学方程式为: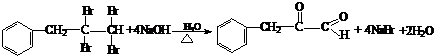
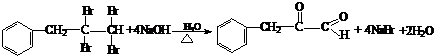
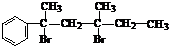 与NaOH的乙醇溶液共热,可以生成
与NaOH的乙醇溶液共热,可以生成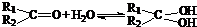 .这是一个可逆反应,平衡状态(平衡的位置)决定于醛酮的结构.若K(H2O)=
.这是一个可逆反应,平衡状态(平衡的位置)决定于醛酮的结构.若K(H2O)=| c[R1R2C(OH)2] |
| c[R1R2C=O] |
| 化合物 |
|
|
|
| ||||||||
| K(H2O) | 2×103 | 1.3 | 0.71 | 8.3×10-3 | ||||||||
| 化合物 |
|
|
|
| ||||||||
| K(H2O) | 2×10-3 | 2.9 | 10 | 很大 |
H C6H5 |
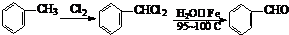 ;②
;②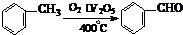
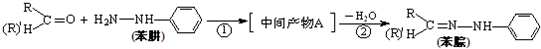
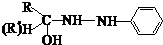
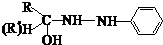
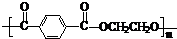 或
或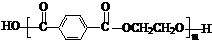
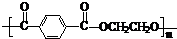 或
或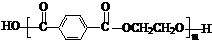
某研究性学习小组探究下列化学反应的特征:
(Ⅰ)硫酸酸化的高锰酸钾溶液氧化KI:KMnO4+KI+H2SO4→MnSO4+I2+KIO3+K2SO4+H2O;
(Ⅱ)Cu2S与一定浓度的HNO3、H2SO4混合液反应:
Cu2S+HNO3+H2SO4→Cu(NO3)2+CuSO4+NO2+NO+H2O;
(Ⅲ)硫酸铜在高温下分解:CuSO4→CuO+SO3+SO2+O2;
(Ⅳ)硫化氢与氢氧化钠溶液反应:NaOH+H2S→NaHS+Na2S+H2O。
(1)绝大多数化学反应中物质的化学计量数之比是固定的。但是,上述化学反应的化学计量数是不确定的,即物质化学计量数有多组。根据上述实例,请你归纳化学计量数有多组的化学反应的特点:_______。
(2)反应(Ⅱ)中只有确定_______的物质的量之比,化学方程式的化学计量数也随之确定。
(3)有人认为反应(Ⅲ)是两个反应式加合的结果,请分析它是哪两个化学反应加合而成的_____;在反应(Ⅲ)中根据化合价守恒,_______的物质的量之比是固定的;根据质量守恒,_______的物质的量之比是固定的。
(4)若硫氢化钠、硫化钠的化学计量数分别为a、b,则用a,b表示该化学反应的化学计量数的化学方程式为________。
(13分)多羟基连在同一个碳原子上易自动失水生成醛或酮
(1)根据上述原理,请写出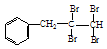 与NaOH的水溶液共热的化学方程式为:
;
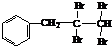
与NaOH的水溶液共热的化学方程式为:
;
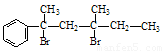 与NaOH的醇溶液共热可以生成 种稳定的二烯烃。
与NaOH的醇溶液共热可以生成 种稳定的二烯烃。
(2)醛酮在水中可生成水合物: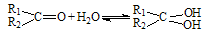 ; 这是一个可逆反应,平衡状态(平衡的位置)决定于醛酮的结构。若
; 这是一个可逆反应,平衡状态(平衡的位置)决定于醛酮的结构。若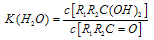 为醛酮的水合平衡常数,其值越大则对应的醛酮水合物越稳定。下表是部分醛、酮的水合平衡常数:
为醛酮的水合平衡常数,其值越大则对应的醛酮水合物越稳定。下表是部分醛、酮的水合平衡常数:
|
化合物 |
|
|
|
|
|
K(H2O) |
2×103 |
1.3 |
0.71 |
8.3×10-3 |
|
化合物 |
|
|
|
|
|
K(H2O) |
2×10-3 |
2.9 |
10 |
很大 |
根据以上表中数据分析,请总结出两条结论:
① 。
② 。
(3)工业上生产苯甲醛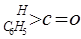 有以下两种方法:
有以下两种方法:
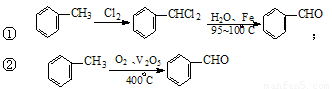
与方法①相比,方法②的优点是 ,
缺点是 。
(4)苯腙是有机染料的主要原料,由醛(或酮)与苯肼生成苯腙的反应为:

反应①的原子利用率为100%,则中间产物A的结构简式为 ;
反应②的反应类型属于 。
(5)由对苯二甲醛的氧化产物“对苯二甲酸”与“乙二醇”缩聚,生成的聚酯纤维(涤纶)
的结构简式为 。
(14分)下表为长式周期表的一部分,其中的编号代表对应的元素。
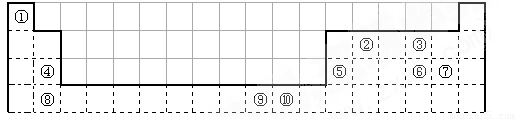
请回答下列问题:
(1)表中属于ds区的元素是 (填编号)。
(2)元素②与③形成的一种化合物是重要的化工原料,该化合物能使澄清石灰水变浑浊。有关该化合物分子的说法正确的是 。
A.分子中含极性共价键 B.属于非极性分子
C.含有1个σ键和2个π键 D.该化合物分子中,②原子采用sp2杂化
(3)根据上述表格中的十种元素填空:
I、金属性最强的主族元素是_____________(填元素名称);
II、⑤、⑥、⑦的离子半径由小到大的顺序是_______________________(填化学式)
III、⑥、⑦两种元素的最高价氧化物对应的水化物的酸性由大到小的顺序是_________
(填化学式),
(4)某元素的特征电子排布式为nsnnpn+1,该元素原子的核外最外层电子的孤对电子数为 _____________;该元素与元素①形成的分子X的空间构型为 。
(15分)氯气的实验室制法是MnO2和浓盐酸在加热条件下反应,用KMnO4、KClO3氧化浓盐酸可快速制取氯气.根据上述反应原理,有人提出能否利用Na2O2的强氧化性氧化浓盐酸得到氯气呢.某课外小组在实验室进行了探索性实验,设计了如图装置:
操作步骤及现在如下:
①组装好装置,检查装置的气密性,加入药品.
②缓慢通入一定量的N2后,将装置E连接好(导管未伸入集气瓶中),再向圆底烧瓶中缓慢滴加浓盐酸,反应剧烈,产生黄绿色气体.
③一段时间后,将导管末端伸入集气瓶中收集气体.装置E中收集到能使带火星的木条复燃的无色气体.
④反应结束后,关闭分液漏斗的活塞,再通入一定量的N2,至装置中气体无色.
回答下列问题:
⑴写出KClO3氧化浓盐酸制取Cl2的离子方程式
⑵装置B中湿润的红色布条褪色,说明A中有 (填化学式)生成,装置C中为湿润的KI-淀粉试纸,能否仅通过试纸变蓝证明上述结论,请用离子方程式说明原因
⑶装置D的作用是
⑷写出生成O2的可能的反应方程式
⑸实验证明,Na2O2甚至能与干燥的HCl反应生成氯气,写出反应的化学方程式
综合上述实验,请分析实验室 (填”能”或”否”)利用Na2O2与浓盐酸反应制备纯净的Cl2,理由是
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com