
题目列表(包括答案和解析)
FeS+H2SO4(稀)══FeSO4+H2S↑
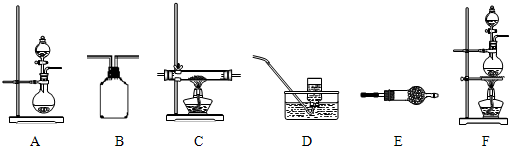
为验证二氧化硫既有还原性又有氧化性,请用下面的试剂和仪器做实验。可选用的试剂:①盐酸 ②溴水 ③亚硫酸钠固体 ④硫化亚铁固体 ⑤品红试液 ⑥氢氧化钠溶液⑦浓硫酸
可选用的仪器装置如图所示。

(1)按二氧化硫气流方向,用橡胶管(图中未画出)连接上述仪器,正确的连接顺序是(用导管口序号填空):________接________,________接________(或________)。
(2)在装置A、B、C中应加入的试剂是(用试剂序号填空):A________,B________,C________。
(3)表现二氧化硫氧化性实验所用的装置是上述装置中的________,实验中观察到的现象是________;表现二氧化硫的还原性实验所用的装置是上述装置中的________,实验中观察到的现象是________,其反应的离子方程式是________。
(4)整套装置最后的气体出口导管应连接________的装置,这样处理的理由是________。
已知实验室可通过下列反应制取硫化氢气体:
FeS+H2SO4(稀)══FeSO4+H2S↑
为验证二氧化硫既有还原性又有氧化性,请用下面的试剂和仪器做实验。可选用的试剂:①盐酸 ②溴水 ③亚硫酸钠固体 ④硫化亚铁固体 ⑤品红试液 ⑥氢氧化钠溶液⑦浓硫酸
可选用的仪器装置如图所示。

(1)按二氧化硫气流方向,用橡胶管(图中未画出)连接上述仪器,正确的连接顺序是(用导管口序号填空):________接________,________接________(或________)。
(2)在装置A、B、C中应加入的试剂是(用试剂序号填空):A________,B________,C________。
(3)表现二氧化硫氧化性实验所用的装置是上述装置中的________,实验中观察到的现象是________;表现二氧化硫的还原性实验所用的装置是上述装置中的________,实验中观察到的现象是________,其反应的离子方程式是________。
(4)整套装置最后的气体出口导管应连接________的装置,这样处理的理由是________。
| 16a |
| 22.4b |
| 16a |
| 22.4b |
| 高温高压 |
| 催化剂 |
| 高温高压 |
| 催化剂 |
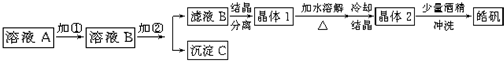
(16分)实验室用铜制取硫酸铜,将适量硝酸分多次加入到铜粉与稀硫酸的混合物中,加热使之反应完全,通过蒸发、结晶得到硫酸铜晶体。
(1)为了节约原料,硫酸和硝酸的物质的量之比最佳为: : ;
为了吸收该反应中产生的尾气,请选择下列中合适的装置 。
(2)为符合绿色化学的要求,某研究性学习小组进行如下设计:
第一组:以空气为氧化剂法
方案1:以空气为氧化剂。将铜粉在仪器X中反复灼烧,使铜与空气充分反应生成氧化铜,再将氧化铜与稀硫酸反应。
方案2:将空气或氧气直接通入到铜粉与稀硫酸的混合物中,发现在常温下几乎不反应。向反应液中加少量FeSO4,即发生反应,生成硫酸铜。反应完全后,加物质甲调节pH ,铁元素全部沉淀(一般认为铁离子的浓度下降到10-5 mol·L-1,就认为沉淀完全。已知: Ksp[Fe((OH)3]≈10-38)然后过滤、浓缩、结晶。
请回答下列问题:
①方案1中的仪器X名称是 。
②方案2为了使铁离子全部沉淀,应调节pH至少为_________。
③方案2中甲物质可选用的是 。
A、 CaO B、NaOH C、CuCO3 D、Cu2(OH)2CO3 E、Fe2(SO4)3
④方案2中加入少量FeSO4可加速铜的氧化,用离子方程式解释其原因
。
第二组:过氧化氢为氧化剂法
将3.2g铜丝放到45 mL 1.5mol·L-1的稀硫酸中,控温在50℃。加入18mL10%的H2O2,反应0.5h,升温到60℃,持续反应1 h后,过滤、蒸发浓缩、减压抽滤等,用少量95%的酒精淋洗后晾干,得CuSO4·5H2O 10.5g。
请回答下列问题:
⑤反应时温度控制在50℃~60℃不宜过高的原因是
⑥本实验CuSO4·5H2O的产率为 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com