
题目列表(包括答案和解析)
(10分) 地下水中硝酸根离子、亚硝酸根离子会造成地下水污染,目前地下水中硝酸根离子经济可行的脱氮方法是在合适的催化剂作用下,用还原剂(如HCOONa)将硝酸根离子还原为氮气而脱氮。
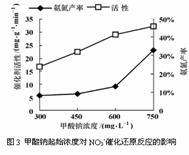
某化学研究性学习小组的同学在技术人员指导下,研究水样中硝酸根起始浓度为100 mg?L- 1条件下,用一定量的催化剂,以甲酸钠进行反硝化脱氮的效率及脱氮的最佳条件,实验中控制起始pH=4.5。经测定得到图1、图2及图3如下。


(1)地下水中硝酸盐可能来源于 ,地下水中硝酸盐含量的增大不仅影响人类和生物体的身体健康,还可能引起 等环境问题。(填一项)
(2)请写出用甲酸钠脱氮的主要离子方程式: 。
(3)分析图1,下列有关说法正确的是( )
A. NO2- 是反应过程中的中间产物
B.NH4+是反应中的一种副产物
C.反应30min后NO3-脱除速率降低,是因为硝酸根离子浓度降低
D.反应进行到75min时,溶液中含氧酸根离子脱除率最高
(4)由图2、图3分析,在本题实验条件下,用甲酸钠进行反硝化脱氮的合适条件:催化剂投入量为 ,甲酸钠起始浓度为 。
(5)根据图1计算,当反应进行至75min时,若NH4+浓度为3.8 mg?L-1,此时水样中氮的脱除效率为 %。(假设实验过程中溶液体积不变,结果保留两位有效数字)



| 一定条件 |
 +(n-1)H20
+(n-1)H20
| 一定条件 |
 +(n-1)H20
+(n-1)H20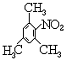



本题有I和II两小题。
Ⅰ.下面a~e是中学化学实验中常见的几种定量仪器:
(a)量筒 (b)容量瓶 (c)滴定管 (d)托盘天平 (e)温度计
(1)其中标示出仪器使用温度的是__________(填写编号)。
(2)能够用以精确量取液体体积的是_______(填写编号)。
(3)由于操作错误,使得到的数据比正确数据偏小的是________(填写编号)。
A.用量筒量取一定量液体时,俯视液面读数
B.中和滴定达终点时俯视滴定管内液面读数
C.使用容量瓶配制溶液时,俯视液面定容所得溶液的浓度
(4)称取10.5 g固体样品(1 g以下使用游码)时,将样品放在了天平的右盘,则所称样品的实际质量为_________g。
(5)有下列实验:
①苯与溴的取代反应 ②苯的硝化反应
③乙醛的银镜反应 ④测定一定温度下KNO3的溶解度
⑤乙酸乙酯的制取 ⑥石油分馏实验
其中需要使用温度计的有___________(填写编号)
Ⅱ.某种胃药片的制酸剂为碳酸钙,其中所含的CaCO3质量的测定如下:
①需配制0.1 mol/L的HCl和0.1 mol/L的NaOH溶液;
②每次取一粒(药片质量均相同)0.2 g的此胃药片,磨碎后加入20.00 mL蒸馏水;
③以酚酞为指示剂,用0.1 mol/L的NaOH溶液滴定,需用去V mL达滴定终点;
④加入25.00 mL 0.1 mol/L的HCl溶液。
(1)写出实验步骤(写编号顺序)___________________________。
(2)在下图所示的仪器中配制0.1 mol/L的HCl溶液和0.1 mol/L的NaOH溶液肯定不需要的仪器是(填序号)________,配制上述溶液还需要的玻璃仪器是(填仪器名称)_________________________。

(3)配制上述溶液应选用的容量瓶规格是_________(填字母)。
A.50 mL 50 mL B.100 mL 100 mL
C.100 mL 150 mL D.250 mL 250 mL
(4)写出有关的化学方程式______________。
(5)每片胃药中含碳酸钙的质量是____________________g。
2004年诺贝尔化学奖授予阿龙·切哈诺沃等三位科学家,以表彰他们发现了泛素调节的蛋白质降解。化合物A是天然蛋白质水解的最终产物,其相对分子质量为165,其中O元素的质量分数小于20%,N元素的质量分数小于10%。
(1)化合物A的分子式为 ;光谱测定显示,化合物A分子结构中不存在甲基(—CH3),则化合物A的结构简式为 。写出A发生缩聚反应的方程式
。
(2)化合物B是A的同分异构体,是某芳香烃一硝化后的唯一产物(硝基连在芳环上)。则化合物B的结构简式是 。
写出制备TNT的化学方程式 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com