
题目列表(包括答案和解析)
22 A、B是两种钠盐,且都是正盐,A中含有两种元素,B中含有三种元素,C是一种常 见的二元强酸,且A、B、C中皆含有同一元素,D有臭鸡蛋气味,它们在水溶液中有如下转化关系:www..com
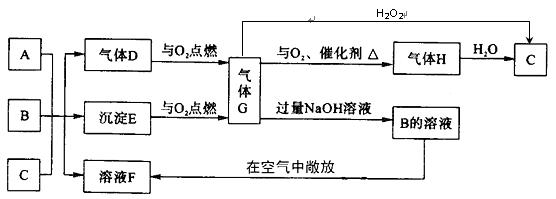
试回答:
(1)A、D、G的化学式分别为 、 、 ![]() [来源:Zxxk.Com]
[来源:Zxxk.Com]
(2)A、B、C反应只生成E和F的离子方程式为 。
(3)要发生上述转化,A、B物质的量之比![]() 应满足的关系是 。
应满足的关系是 。
(4)气体G可使高锰酸钾溶液褪色,发生反应的离子方程式为 。
| I1 | I2 | I3 | I4 | |
| C | 738 | 1451 | 7733 | 10540 |
| D | 577 | 1817 | 2745 | 11578 |
| 单键 | 双键 | 叁键 | ||
| AB | 键能(kJ?mol-1) | 357.7 | 798.9 | 1071.9 |
| 甲 | 键能(kJ?mol-1) | 154.8 | 418.4 | 941.7 |
 (4)E能与AB形成配合物,其中E提供
(4)E能与AB形成配合物,其中E提供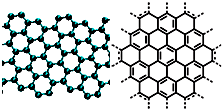 A.美国《科学》杂志评出的2009年十大科学突破之一是石墨烯的研究和应用方面的突破.石墨烯具有原子级的厚度、优异的电学性能、出色的化学稳定性和热力学稳定性.制备石墨烯方法有石墨剥离法、化学气相沉积法等.石墨烯的球棍模型及分子结构示意图如右:
A.美国《科学》杂志评出的2009年十大科学突破之一是石墨烯的研究和应用方面的突破.石墨烯具有原子级的厚度、优异的电学性能、出色的化学稳定性和热力学稳定性.制备石墨烯方法有石墨剥离法、化学气相沉积法等.石墨烯的球棍模型及分子结构示意图如右: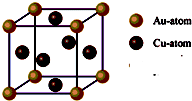
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com