
题目列表(包括答案和解析)
(10分) 1L某混合溶液,可能含有的离子如下表:
| 可能大量含有的阳离子 | H+、K+、Mg2+、Al3+、NH、Fe2+、Fe3+ |
| 可能大量含有的阴离子 | Cl-、Br-、I-、CO32-、AlO |
⑴ 往该溶液中逐滴加入NaOH溶液,产生沉淀的物质的量(n)
与加入NaOH溶液的体积(V)的关系如右图所示。
则该溶液中一定不含有的离子是_________。
(2)BC段离子方程式为 。
(3)V1 、V2、V3、 V4之间的关系 。
(4)经检测,该溶液中还含有大量的Cl-、Br-、I-,若向1L该混合溶液中通入一定量的
Cl2,溶液中Cl-、Br-、I-的物质的量与通入Cl2的体积(标准状况)的关系如下表所示,
分析后回答下列问题:
| Cl2的体积(标准状况) | 2.8L | 5.6L | 11.2L |
| n(Cl-) | 1.25mol | 1.5mol | 2mol |
| n(Br-) | 1.5mol | 1.4mol | 0.9mol |
| n(I-) | a mol | 0 | 0 |
①当通入Cl2的体积为2.8L时,溶液中发生反应的离子方程式为___________________。
②原溶液中Cl-、Br-、I-的物质的量浓度之比为____________________。
(10分,每空格2分)原子结构与元素周期表存在着内在联系。请回答下列问题:
(1)具有(n-1)d10ns电子构型的元素位于周期表中 区。
(2)被誉为“21世纪金属”的钛(Ti)元素原子的价电子排布式为: 。
(3)写出地壳中含量最多的金属元素原子的核外电子排布式 。
(4)写出3p轨道上有2个未成对电子的元素的符号: 。
(5)已知Ti3+可形成配位数为6,颜色不同的两种配合物晶体,一种为紫色,另一为绿色。两种晶体的组成都为TiCl3·6H2O。为测定这两种晶体的化学式,设计了如下实验:a分别取等质量的两种配合物晶体的样品配成待测溶液;b分别往待测溶液中滴入AgNO3溶液,均产生白色沉淀;c沉淀完全后分别过滤得两份沉淀,经洗涤干燥后称量,发现原绿色晶体的水溶液得到的白色沉淀质量为紫色晶体的水溶液反应得到沉淀质量的 。该绿色晶体配合物的化学式为
。该绿色晶体配合物的化学式为
(10分) 将0.1 mol的镁、铝混合物溶于100 mL 2mol/LH2SO4溶液中,然后再滴加1 mol/L NaOH溶液。请回答:
⑴若在滴加NaOH溶液的过程中,沉淀质量m随加入NaOH溶液的体
积V变化如右图所示。当V1=140mL时,则金属粉末中
n(Mg)= mol,V2= mL。
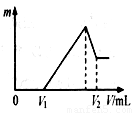
⑵若在滴加NaOH溶液过程中,欲使Mg2+、Al3+刚好沉淀完全,则滴
入NaOH溶液的体积V(NaOH) mL。
⑶若混合物仍为0.1 mol,其中Mg粉的物质的量分数为a,用100 mL 2 mol/L的硫酸溶解此混合物后,再加入480 mL 1mol/L的NaOH溶液,所得沉淀中无Al(OH)3。满足此条件的a的取值范围是:
(4)若滴加NaOH溶液致V2ml时,停止滴加NaOH溶液,开始往溶液中通入足量CO2,请写出发生反应的离子方程式——————————————————————-————。
(10分)、在537℃、1.01×105Pa时,往容积可变的密闭容器中充入1molX和3molY,此时容积为VL。保持恒温恒压,发生反应X(g)+
3Y(g)  2Z(g),达到平衡时,平衡混合气体中Z的体积分数为0.5。
2Z(g),达到平衡时,平衡混合气体中Z的体积分数为0.5。
(1)达到平衡时,X的转化率约为 。
(2)保持上述温度和压强恒定不变,若向容器中只充入4molZ,则反应达到平衡时,平衡气体中Y的体积分数为 ,容器的容积为 L。
(3)若另选一容积固定不变的密闭容器,仍控制温度不变,使2molX和6molY反应,达到平衡时平衡气体中Z的体积分数仍为0.5,则该密闭容器的容积为
(4)若温度仍为537℃,容器体积保持VL不变(恒容),往其中充入a mol X的b mol Y,使反应达到平衡,这时平衡气体中Z的体积分数仍为0.5,体系压强为1.01×105Pa,若a : b = 1 : 3,则a=
(10分)硫酸铵是一种常用的铵态氮肥。下表是硫酸铵化肥品质的主要指标。
| 指标 项目 | 优等品 | 一等品 | 合格品
|
| 外观 | 白色结晶,无可见机械杂质 | 无可见机械杂质 | |
| 氮(N)含量 | ≥21.0% | ≥21.0% | ≥20. 5% |
新华中学化学研究性学习小组为本地农业生产服务,对某农用品商店出售的一等品硫酸铵化肥的品质进行探究。
[观察外观] 该硫酸铵化肥无可见机械杂质。
[实验探究]按右图所示装置进行实验。
(1)烧瓶内发生反应的离子方程式为:_________________________________________________
烧杯中盛放的试剂最好是 ___ __(填“浓硫酸”、“稀硫酸”或“水”)。
(2)实验过程中,需往烧瓶中加入足量浓氢氧化钠溶液并充分加热的原因是_________________________________。
[交流讨论]?
甲同学:根据此实验测得的数据,计算硫酸铵化肥的含氮量可能偏高,因为实验装置中存在一个明显缺陷是:__________________________________________________。
乙同学:实验装置中还存在另一个明显缺陷是:___________________________________________________________________________________________________ 。
经过大家充分讨论一致认为:针对甲、乙两位同学指出的实验装置中存在的明显缺陷,需改进实验装置,重新进行实验。
[探究结论]
称取13.5 g硫酸铵化肥样品,用改进后的实验装置重新进行实验,测得实验前后B装置增重3.40 g。该化肥 (填“是”或“不是”)一等品。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com