
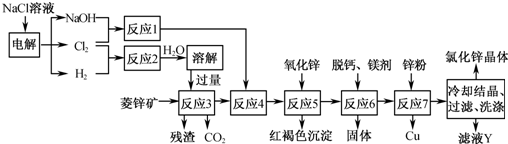
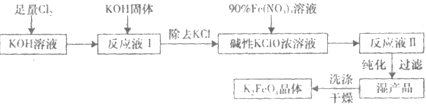
题目列表(包括答案和解析)

| 氢氧化物开始沉淀时的pH | 氢氧化物沉淀完全时的 pH | |
| Fe3+ Cu2+ |
1.9 4.7 |
3.2 6.7 |
| ||
| ||
| 1 |
| 3 |
| 1 |
| 3 |
(10分)W、X、Y、Z是周期表前36号元素中的四种常见元素,其原子序数依次增大。W、Y的氧化物是导致酸雨的主要物质,X的基态原子核外有7个原子轨道填充了电子,Z能形成红色(或砖红色)的Z2O和黑色的ZO两种氧化物。
(1)W的气态氢化物化学式为 ,它的沸点比PH3的沸点 ,
(填“高”或“低”)W的气态氢化物稳定性比H2O(g)________(填“强”或“弱”)。
(2)Y的基态原子核外电子排布式是________ ______,Y的第一电离能比X的______ __(填“大”或“小”)。
(3)Y的最高价氧化物对应水化物的浓溶液与Z的单质反应的化学方程式是
。
(4)已知下列数据:
Fe(s)+1/2O2(g)===FeO(s) ΔH=-272.0 kJ·mol-1
2X(s)+3/2O2(g)===X2O3(s) ΔH=-1 675.7 kJ·mol-1
X的单质和FeO反应的热化学方程式是___________ ___________________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com