化学反应与能量有比不可分的关系,回答下列问题.
Ⅰ:已知31g白磷变为31g红磷释放能量.试回答:
(1)上述变化属于
化学
化学
(填“物理”或“化学”)变化.
(2)31g白磷具有的能量_
>
>
(“>”或“<”)31g红磷具有的能量,常温常压下,
红磷
红磷
更稳定.
(3)31g白磷完全燃烧释放的能量_
>
>
(“>”或“<”)31g红磷完全燃烧释放的能量.
Ⅱ:A、B、C三个烧杯中分别盛有200mL相同物质的量浓度的稀硫酸
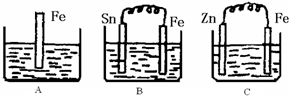
(1)分别写出三个装置中铁片表面发生反应的离子方程式:
A
Fe+2H+=Fe2++H2↑
Fe+2H+=Fe2++H2↑
;B
Fe-2e-═Fe2+
Fe-2e-═Fe2+
;C
2H++2e-═H2↑
2H++2e-═H2↑
.
(2)一段时间后,B中Sn极附近溶液的pH
pH增大
pH增大
(填“增大”、“减小”、“不变”).
(3)一段时间后,C中产生了3.36L(标准状况)气体时,硫酸恰好全部被消耗,则原稀硫酸溶液的物质的量浓度=
0.75
0.75
mol?L
-1.此时,三个烧杯中液体质量由大到小的顺序为:
C>A=B
C>A=B
(填写序号).
(4)比较A、B、C中铁被腐蚀的速率,由快到慢的顺序是
BAC
BAC
(填写序号).
Ⅲ:某温度时,在一个2L的密闭容器中,X、Y、Z三种物质的物质的量随时间的变化曲线如图所示.根据图中数据填空:
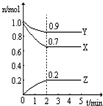
(1)该反应的化学方程式为
3X+Y

2Z
3X+Y

2Z
.
(2)反应开始至2min,以气体Z表示的平均反应速率为
0.05mol/(L.min)
0.05mol/(L.min)
.
(3)若X、Y、Z均为气体,2min后反应达到平衡,反应达平衡时:
①此时体系的压强是开始时的
0.9
0.9
倍;
②达平衡时,容器内混合气体的平均相对分子质量比起始投料时
增大
增大
(填“增大”“减小”或“相等”).



 2Z
2Z 2Z
2Z