
题目列表(包括答案和解析)
(本题16分)降低大气中CO2的含量和有效地开发利用CO2正成为研究的主要课题。
(1)已知在常温常压下:
① 2CH3OH(l) + 3O2(g) = 2CO2(g) + 4H2O(g) ΔH =-1275.6 kJ/mol
② 2CO (g)+ O2(g) = 2CO2(g) ΔH =-566.0 kJ/mol
③ H2O(g) = H2O(l) ΔH =-44.0 kJ/mol
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式: 。
(2)在容积为2L的密闭容器中,充入2mol CO2和6mol H2,在温度500℃时发生反应:
CO2(g)+ 3H2(g)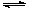 CH3OH(g)+ H2O(g) △H<0。CH3OH的浓度随时间变化如图。回答有关问题:
CH3OH(g)+ H2O(g) △H<0。CH3OH的浓度随时间变化如图。回答有关问题: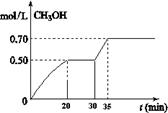
①从反应开始到20分钟时,H2的平均反应速率v(H2)=_________________。
②从30分钟到35分钟达到新的平衡,改变的条件可能是 。
A. 增大压强 B.加入催化剂 C.升高温度 D.增大反应物的浓度
③列式计算该反应在35分钟达到新平衡时的平衡常数(保留2位小数)
④如果在30分钟时,再向容器中充入2mol CO2和6mol H2,保持温度不变,达到新平衡时,CH3OH的浓度____________1mol.L-1(填“>”、“<”或“=”)。
(3)一种原电池的工作原理为:2Na2S2 + NaBr3  Na2S4 + 3NaBr。用该电池为电源,以氢氧化钾水溶液作电解质进行电解,使CO2在铜电极上可转化为甲烷。
Na2S4 + 3NaBr。用该电池为电源,以氢氧化钾水溶液作电解质进行电解,使CO2在铜电极上可转化为甲烷。
①该电池负极的电极反应式为: 。
②电解池中产生CH4一极的电极反应式为: 。
(4)下图是NaOH吸收CO2后某种产物的水溶液在pH从0至14的范围内H2CO3、HCO3-、CO32-三种成分平衡时的组成分数。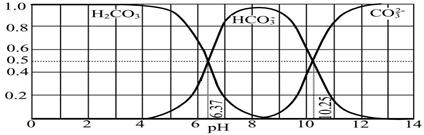
下列叙述正确的是 。
A.此图是1.0 mol·L-1碳酸钠溶液滴定1.0 mol·L-1 HCl溶液的滴定曲线
B.在pH分别为6.37及10.25时,溶液中c(H2CO3)=c(HCO3-)=c(CO32-)
C.人体血液的pH约为7.4,则CO2在血液中多以HCO3-形式存在
D.若用CO2和NaOH反应制取NaHCO3,宜控制溶液的pH为7~9之间
 CH3OH(g)+ H2O(g) △H<0。CH3OH的浓度随时间变化如图。回答有关问题:
CH3OH(g)+ H2O(g) △H<0。CH3OH的浓度随时间变化如图。回答有关问题: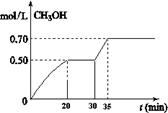
 Na2S4 + 3NaBr。用该电池为电源,以氢氧化钾水溶液作电解质进行电解,使CO2在铜电极上可转化为甲烷。
Na2S4 + 3NaBr。用该电池为电源,以氢氧化钾水溶液作电解质进行电解,使CO2在铜电极上可转化为甲烷。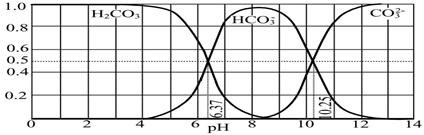
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com