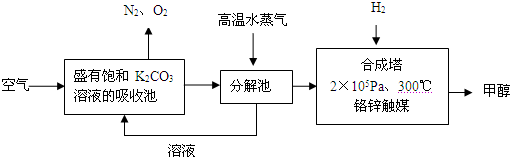
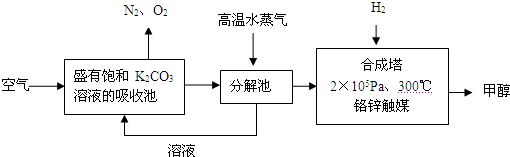
(2009?江门一模)实验室制备纯碱的主要步骤是:
①将配制好的饱和NaCl溶液倒入烧杯中加热,控制温度在30-35℃,搅拌下分批加入研细的NH
4HCO
3固体
②加料完毕后,继续保温30分钟
③静置、过滤得NaHCO
3晶体
④用少量蒸馏水洗涤除去杂质,抽干后,转入蒸发皿中,灼烧,制得Na
2CO
3固体.
四种盐在不回温度下的溶解度(g/l00g水)表
 |
0℃ |
10℃ |
20℃ |
30℃ |
40℃ |
50℃ |
60℃ |
100℃ |
| NaCl |
35.7 |
35.8 |
36.0 |
36.3 |
36.6 |
37.0 |
37.3 |
39.8 |
| NH4HCO3 |
11.9 |
15.8 |
21.0 |
27.0 |
-① |
|
|
|
| NaHCO3 |
6.9 |
8.1 |
9.6 |
11.1 |
12.7 |
14.5 |
16.4 |
|
| NH4Cl |
29.4 |
33.3 |
37.2 |
41.4 |
45.8 |
50.4 |
55.3 |
77.3 |
①>35℃NH
4HC0
3会有分解
请回答:
(1)反应温度控制在30-35℃,是因为
温度高于35℃NH4HCO3分解,温度低于30℃反应速率降低
温度高于35℃NH4HCO3分解,温度低于30℃反应速率降低
;为控制此温度范围,采取的加热方法为
水浴加热
水浴加热
.
(2)加料完毕后,继续保温30分钟,目的是
使反应充分反应
使反应充分反应
;静置后只析出NaHCO
3品体的原因是
碳酸氢钠溶解度最小
碳酸氢钠溶解度最小
.
(3)洗涤NaHCO
3晶体的操作是
把蒸馏水沿着玻璃棒注入到过滤器中至浸没沉淀,静置待蒸馏水滤出,重复操作2-3次
把蒸馏水沿着玻璃棒注入到过滤器中至浸没沉淀,静置待蒸馏水滤出,重复操作2-3次
.
(4)过滤所得的母液中含有的溶质
NH4Cl NaCl NH4HCO3 NaHCO3
NH4Cl NaCl NH4HCO3 NaHCO3
(以化学式表示).
(5)写出本实验中制备纯碱的有关化学方程式
NH4HCO3+NaCl=NaHCO3↓+NH4Cl
NH4HCO3+NaCl=NaHCO3↓+NH4Cl
.
(6)测试纯碱产品中NaHCO
3含量的方法是:准确称取纯碱样品W g,放入锥形瓶中加蒸馏水溶解,加1-2滴酚酞指示剂,用物质的量浓度为c (mol/L)的HCl溶液滴定至溶液由红色到无色,所用HCl溶液体积为V
1 mL,再加1-2滴甲基橙指示剂,继续用HCl溶液滴定至溶液由黄变橙,所用HCl溶液总体积为V
2mL,写出纯碱样品中NaHCO
3质量分数的计算式:
.