
题目列表(包括答案和解析)
(8分)实验室常用的几种气体发生装置如图A、B、C所示:
(1)实验室可以用B或C装置制取氨气,如果用C装置,通常使用的药品是________;
检查C装置气密性是否良好的操作方法是________。
(2)气体的性质是选择气体收集方法的主要依据。下列性质与收集方法无关的是________(填序号,下同)。
①密度 ②颜色 ③溶解性 ④热稳定性 ⑤与氧气反应
下图是某学生设计收集气体的几种装置,其中不可行的是________。
(3)若用A装置与D装置相连制取收集X气体,则X可能是下列气体中的________。
①CO2 ②NO ③Cl2 ④H2
(8分)(2011·重庆万州调研)为确认C6H5OH、H2CO3和CH3COOH的酸性强弱,某学生设计了如图所示的装置,一次实验即可达到目的(不必选其他酸性物质)。
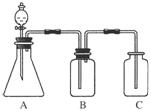
请据此实验回答:
(1)锥形瓶中装某可溶性正盐溶液,分液漏斗中所盛试剂应为________。
(2)装置B所盛的试剂是________,其作用是______________________________。
(3)装置C所盛的试剂是________,C中反应的离子方程式是______________________。
(本小题满分8分)某学生为了探究锌与盐酸反应过程中的速率变化,他在100mL稀盐酸中加入足量的锌粉,用排水集气法收集反应放出的氢气,实验记录如下(累计值,体积已换算成标准状态):
| 时间(min) | 0 | 1 | 2 | 3 | 4 | 5 |
| 氢气体积(mL) | 0 | 50 | 120 | 232 | 290 | 310 |
(8分)下图是硫酸试剂瓶标签上的内容: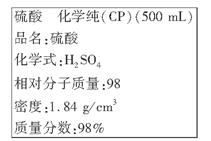
(1)该硫酸的物质的量浓度是________mol/L。
(2)某化学兴趣小组进行硫酸性质的实验探究时,需要240 mL 4.6 mol/L的稀硫酸,则需要取________mL的该硫酸。将上述硫酸进行稀释的实验操作是_____________________。
(3)在配制4.6 mol/L的稀硫酸的过程中,下列情况对硫酸溶液物质的量浓度有何影响(填“偏高”、“偏低”或“无影响”)
①未经冷却趁热将溶液注入容量瓶中________;
②容量瓶用1 mol/L稀硫酸润洗________;
③定容时仰视观察液面________。
(4)常温下,某学生取出少量试剂瓶中的硫酸于一洁净试管中,加几片铝,结果铝片表面没有气泡产生,也未发现铝片溶解,试帮助该同学分析原因______________________。
(8分)某学生欲用已知物质的量浓度的盐酸来测定未知物质的量浓度的NaOH溶液,选择甲基橙作指示剂.请填写下列空白:
(1)用标准的盐酸滴定待测的NaOH溶液时,左手握酸式滴定管的活塞,右手摇动锥形瓶,眼睛注视_____________,滴定终点的判断方法是________________________。
(2)下列操作中可能使所测NaOH溶液的浓度数值偏低的是 .
A.酸式滴定管未用标准盐酸润洗就直接注入标准盐酸
B.滴定前盛放NaOH溶液的锥形瓶用蒸馏水洗净后没有干燥
C.酸式滴定管在滴定前有气泡,滴定后气泡消失
D.读取盐酸体积时,开始仰视读数,滴定结束时俯视读数
(3)若滴定开始和结束时,酸式滴定管中的液面如图所示,所用盐酸溶液的体积为_______mL.
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com