Ⅰ工业上铜的冶炼常采取火法熔炼工艺.以辉铜矿(主要成分 Cu
2S)为原料,该过程中有如下反应:
2Cu
2S(s)+3O
2(g)=2Cu
2O(s)十2SO
2(g)△H=-768.2KJ?mol
-12Cu
2O(s)+Cu
2S(s)=6Cu(s)+SO
2(g)△H=+116.0KJ?mol
-1反应Cu
2S(s)+O
2(g)=2Cu(s)+SO
2(g)的△H=
-217.4KJ/mol
-217.4KJ/mol
.
在上述工业生产过程中产生的SO
2气体直接排放会污染大气.工业上常用氨水吸收SO
2,反应的化学方程式为
SO2+2NH3?H2O=(NH4)2SO3+H2O或 SO2+NH3?H2O=NH4HSO3
SO2+2NH3?H2O=(NH4)2SO3+H2O或 SO2+NH3?H2O=NH4HSO3
.
Ⅱ大气污染的另一个重要问题是臭氧层的破坏.为妥善处理氯甲烷生产企业的副产物CCl
4,以减少其对臭氧层的破坏.化学家研究在催化条件下,通过下列反应,使CCl
4转化为重要的化工原料氯仿(CHCl
3).CCl
4(g)+H
2(g)
CHCl
3(g)+HCl(g).此反应伴随有副反应,会生成CH
2Cl
2、CH
3Cl和CH
4等.已知CCl
4的沸点为 77℃,CHCl
3的沸点为 61.2℃.
如果不考虑反应过程中的副反应,在一个密闭容器中发生上述反应,该反应达到平衡后,测得下表中的数据.
| 实验序号 |
温度℃ |
初始CCl4浓度(mol?L-1) |
初始H2浓度(mol?L-1) |
CCl4的转化率 |
| 1 |
110 |
0.8 |
1.2 |
a |
| 2 |
110 |
1 |
1 |
50% |
| 3 |
120 |
1 |
2 |
x |
| 4 |
120 |
1 |
4 |
请回答下列问题:
(1)实验1中,CCl
4的转化率a
大于
大于
50%(填“大于”“小于”“等于”);
(2)在实验2的平衡体系中,再加入0.5mol?L
-1CCl
4和1mol?L
-1HCl,平衡将向
逆
逆
反应方向移动(填“正”、“逆”或“不移动”).
(3)120℃,在相同条件的密闭容器中,分别进行实验3、4,测得CCl
4的转化率(x)和生成物中CHCl
3的体积分数(y)随时间(t)的变化关系如图(图中实线是CCl
4转化率变化曲线,虚线是产物中CHCl
3的体积分数变化曲线).
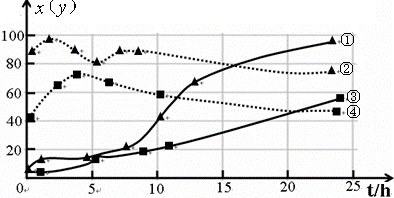
图中的四条线中,表示H
2起始浓度为2mol?L
-1实验中CCl
4的转化率(x)变化曲线是
③
③
(选填序号).根据上图曲线,氢气的起始浓度为
4mol/L
4mol/L
有利于提高CCl
4的平衡转化率.

