
题目列表(包括答案和解析)
多晶硅是太阳能光伏产业的重要原料。
(1)由石英砂可制取粗硅,其相关反应的热化学方程式如下:
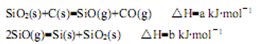
①反应SiO2(s)+2C(s)=Si(s)+2CO(g)的△H= kJ·mol-1(用含a、b的代数式表示)。
②SiO是反应过程中的中间产物。隔绝空气时,SiO与NaOH溶液反应(产物之一是硅酸钠)的化学方程式是 。
(2)粗硅提纯常见方法之一是先将粗硅与HCl制得SiHCl3,经提纯后再用H2还原:SiHCl3(g)+H2(g) Si(s)+3HCl(g)不同温度及不同n(H2)/n(SiHCl3)时,反应物X的平衡转化率关系如图;
Si(s)+3HCl(g)不同温度及不同n(H2)/n(SiHCl3)时,反应物X的平衡转化率关系如图;

①X是 (填“H2”、“SiHCl3”)。
②上述反应的平衡常数K(1150℃) K(950℃)(选填“>”、“<”、“=”)
(3)SiH4(硅烷)法生产高纯多晶硅是非常优异的方法。
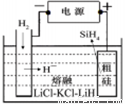
①用粗硅作原料,熔盐电解法制取硅烷原理如图10,电解时阳极的电极反应式为 。
②硅基太阳电池需用N、Si两种元素组成的化合物Y作钝化材料,它可由SiH4与NH3混合气体进行气相沉积得到,已知Y中Si的质量分数为60%,Y的化学式为 。

多晶硅是太阳能光伏产业的重要原料。
(1)由石英砂可制取粗硅,其相关反应的热化学方程式如下:

①反应SiO2(s)+2C(s)=Si(s)+2CO(g)的△H= kJ·mol-1(用含a、b的代数式表示)。
②SiO是反应过程中的中间产物。隔绝空气时,SiO与NaOH溶液反应(产物之一是硅酸钠)的化学方程式是 。
(2)粗硅提纯常见方法之一是先将粗硅与HCl制得SiHCl3,经提纯后再用H2还原:SiHCl3(g)+H2(g) Si(s)+3HCl(g)不同温度及不同n(H2)/n(SiHCl3)时,反应物X的平衡转化率关系如图;
Si(s)+3HCl(g)不同温度及不同n(H2)/n(SiHCl3)时,反应物X的平衡转化率关系如图;

①X是 (填“H2”、“SiHCl3”)。
②上述反应的平衡常数K(1150℃) K(950℃)(选填“>”、“<”、“=”)
(3)SiH4(硅烷)法生产高纯多晶硅是非常优异的方法。
①用粗硅作原料,熔盐电解法制取硅烷原理如图10,电解时阳极的电极反应式为 。
②硅基太阳电池需用N、Si两种元素组成的化合物Y作钝化材料,它可由SiH4与NH3混合气体进行气相沉积得到,已知Y中Si的质量分数为60%,Y的化学式为 。
多晶硅是太阳能光伏产业的重要原料。
(1)由石英砂可制取粗硅,其相关反应的热化学方程式如下: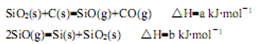
①反应SiO2(s)+2C(s)=Si(s)+2CO(g)的△H= kJ·mol-1(用含a、b的代数式表示)。
②SiO是反应过程中的中间产物。隔绝空气时,SiO与NaOH溶液反应(产物之一是硅酸钠)的化学方程式是 。
(2)粗硅提纯常见方法之一是先将粗硅与HCl制得SiHCl3,经提纯后再用H2还原:SiHCl3(g)+H2(g) Si(s)+3HCl(g)不同温度及不同n(H2)/n(SiHCl3)时,反应物X的平衡转化率关系如图;
Si(s)+3HCl(g)不同温度及不同n(H2)/n(SiHCl3)时,反应物X的平衡转化率关系如图;
①X是 (填“H2”、“SiHCl3”)。
②上述反应的平衡常数K(1150℃) K(950℃)(选填“>”、“<”、“=”)
(3)SiH4(硅烷)法生产高纯多晶硅是非常优异的方法。
①用粗硅作原料,熔盐电解法制取硅烷原理如图10,电解时阳极的电极反应式为 。
②硅基太阳电池需用N、Si两种元素组成的化合物Y作钝化材料,它可由SiH4与NH3混合气体进行气相沉积得到,已知Y中Si的质量分数为60%,Y的化学式为 。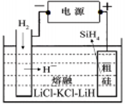

 Si(s)+3HCl(g)不同温度及不同n(H2)/n(SiHCl3)时,反应物X的平衡转化率关系如图;
Si(s)+3HCl(g)不同温度及不同n(H2)/n(SiHCl3)时,反应物X的平衡转化率关系如图;

碳、硅元素的单质及其化合物是构成自然界的重要物质。
(1)甲烷是最简单的有机物,实验室可通过下列反应制取:CH3COONa+NaOH CH4↑+X(已配平)
CH4↑+X(已配平)
①X属于 晶体(填晶体类型)。
②MgO晶体的熔点比CaO高,主要原因是 。
(2)金刚石和石墨是两种重要的碳单质。
①以Ni—Cr—Fe为催化剂,一定条件下可将石墨转化为金刚石。基态Cr3+离子中未成对电子数有 个。
②石墨晶体具有层状结构,在层与层之间嵌入金属K原子,能形成石墨夹层离子化合物(KC8),KC8固态时也能导电,导电的粒子是 。
(3)硅烷(SiH4)的结构与甲烷相似。SiH4分子中共价键的类型是 ;硅烷能与硝酸银发生如下反应:SiH4+8 AgNO3+2 H2O =" 8" Ag↓+SiO2↓+8 HNO3
该反应中氢元素被氧化,由此可判断电负性:Si H(填“>”、“<”或“=”)
(4)下图中,能正确表示与Si同周期部分元素的第三电离能(I3)与原子序数关系的
是 (填标号)。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com