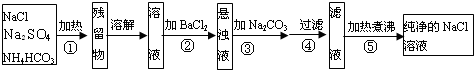
为了将混有硫酸钠、氯化铵的氯化钠固体提纯,并制得纯净的氯化钠溶液,某学生设计了图所示实验.根据图回答下列问题.

(1)操作①发生反应的化学方程式为
.
(2)操作②中能否用硝酸钡溶液?
否
否
(填写“能”或“否”).说明理由
用硝酸钡会引入新杂质NO3-
用硝酸钡会引入新杂质NO3-
.
(3)进行操作②后,判断SO
42-已经除尽的方法是
取少量上层澄清溶液,再滴加BaCl2溶液,如无沉淀出现则说明SO42-已除尽,反之则有(或其他的方法)
取少量上层澄清溶液,再滴加BaCl2溶液,如无沉淀出现则说明SO42-已除尽,反之则有(或其他的方法)
.
(4)操作④需要用到的玻璃仪器是
玻璃棒、漏斗、烧杯
玻璃棒、漏斗、烧杯
.
(5)此实验最终并不能得到纯净的NaCl溶液,改进的方法是
在⑤处应先加入过量的盐酸后再加热煮沸
在⑤处应先加入过量的盐酸后再加热煮沸
.



 已除尽,方法是 .
已除尽,方法是 .