
题目列表(包括答案和解析)
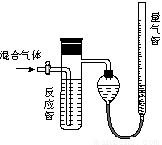
工业上测定SO2、N2、O2混合气体中SO2含量的装置如图。反应管中装有碘的淀粉溶液,SO2和I2发生反应为(N2、O2不与I2反应):SO2+I2+2H2O=H2SO4+2HI
(1)混合气体进入反应管后,量气管内增加的水的体积等于_____________的体积(填写混合气体的分子式)
(2)读数前应冷却到室温、______________、___________
(3)反应管内溶液蓝色消失后,没有及时停止通气,则测得的SO2含量_______(选填:偏高,偏低,不受影响)
(4)若碘溶液体积为Va mL,浓度为Cmol/L。N2与O2的体积为Vb mL(已折算成标准状况下的体积)。用C、Va、Vb表示SO2的体积百分含量为______________________。
工业上测定SO2、N2、O2混合气体中SO2含量的装置如图。反应管中装有碘的淀粉溶液,SO2和I2发生反应为(N2、O2不与I2反应):SO2+I2+2H2O=H2SO4+2HI
(1)混合气体进入反应管后,量气管内增加的水的体积等于_____________的体积(填写混合气体的分子式)
(2)读数前应冷却到室温、______________、___________
(3)反应管内溶液蓝色消失后,没有及时停止通气,则测得的SO2含量_______(选填:偏高,偏低,不受影响)
(4)若碘溶液体积为Va mL,浓度为Cmol/L。N2与O2的体积为Vb mL(已折算成标准状况下的体积)。用C、Va、Vb表示SO2的体积百分含量为______________________。
工业上测定SO2、N2、O2混合气体中SO2含量的装置如右图。反应管中装有碘的淀粉溶液,SO2和I2发生反应为(N2、O2不与I2反应):SO2+I2+2H2O==H2SO4+2HI
(1)混合气体进入反应管后,量气管内增加的水的体积等于_____________的体积(填写混合气体的分子式)
(2)读数前应冷却到室温、______________、___________
(3)反应管内溶液蓝色消失后,没有及时停止通气,则测得的SO2含量_______(选填:偏高,偏低,不受影响)
(4)若碘溶液体积为Va mL,浓度为Cmol/L。N2与O2的体积为Vb mL(已折算成标准状况下的体积)。用C、Va、Vb表示SO2的体积百分含量为______________________。

湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com