(1)电池反应通常是放热反应,下列反应在理论上可设计成原电池的化学反应是
(填序号).此类反应具备的条件是①
反应,②
反应.
A.C(s)+H
2O(g)═CO(g)+H
2(g)△H>0
B.Ba(OH)
2?8H
2O(s)+2NH
4Cl(s)═BaCl
2(aq)+2NH
3?H
2O( 1)+8H
2O( 1)
△H>0
C.CaC
2(s)+2H
2O( 1)═Ca(OH)
2(s)+C
2H
2(g)△H<0
D.CH
4(g)+2O
2(g)═CO
2(g)+2H
2O( 1)△H<0
(2)以KOH溶液为电解质溶液,依据(I)所选反应设计一个电池.其负极反应为:
.
(3)电解原理在化学工业中有广泛的应用.现将你设计的原电池通过导线与图中电解池相连,其中a为电解液,X和Y是两个电极,
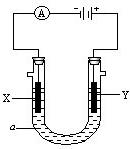
①若X和Y均为惰性电极,a为饱和食盐水,则电解时检验Y电极反应产物的方法是
.
②若X、Y分别为石墨和铁,a仍为饱和的NaCl溶液,则电解过程中生成的白色固体露置在空气中,可观察到的现象是
.
③若X和Y均为惰性电极,a为一定浓度的硫酸铜溶液,通电后,发生的总反应化学方程式为
.通电一段时间后,向所得溶液中加入0.05mol Cu(OH)
2,恰好恢复电解前的浓度和pH,则电解过程中电子转移的物质的量为
mol.
(4)利用工业上离子交换膜法制烧碱的原理,用如图所示装置电解K
2SO
4溶液.
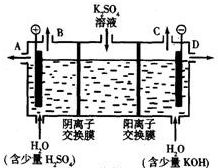
①该电解槽的阳极反应式为
,通过阴离子交换膜的离子数
(填“>”、“<”或“=”)通过阳离子交换膜的离子数;
②图中a、b、c、d分别表示有关溶液的pH,则a、b、c、d由小到大的顺序为
;
③电解一段时间后,B口与C口产生气体的质量比为
.

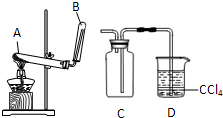 某校化学小组的同学欲用如图所示装置在实验室中制取氨气,
某校化学小组的同学欲用如图所示装置在实验室中制取氨气,

