(1)铝是地壳中含量最大的金属,铝质轻,燃烧时放热量高,在常温常压下,9g的铝粉完全燃烧生成固态的A
2O
3时放出235kJ的热,则这个反应的热化学方程式为
4Al(s)+3O2(g)=2Al2O3(s),△H=2820KJ/mol
4Al(s)+3O2(g)=2Al2O3(s),△H=2820KJ/mol
;
(2)中国是世界上最大的电冶铝国家之一,电冶铝的原料是氧化铝,在熔融下进行电解,试写出电解法冶炼铝的方程式为
;
(3)铝用途很广,在电化学中常用于充当电极材料.把铝和镁用导线连接后,若插入到稀硫酸中,则正极是
2H++2e-=H2↑
2H++2e-=H2↑
,插入氢氧化钠溶液中,负极的电极反应式是
Al-3e-+4HO-=AlO2-+2H2O
Al-3e-+4HO-=AlO2-+2H2O
(4)中国首创的海洋铝矿灯,是以铝、空气和海水为原料所设计的原电池,当把电池置于海水电池就有较大的电压,此电池的正极反应式为
Al-3e-=Al3+
Al-3e-=Al3+
.
(5)采用惰性电极从NO
3-、SO
42-、Cl
-、Cu
2+、Mg
2+、H
+中选出适当的离子组成电解质,并对其溶液进行电解
①若两极分别放出H
2和O
2,则电解质的化学式为
HNO3、H2SO4、Mg(NO3)2、MgSO4
HNO3、H2SO4、Mg(NO3)2、MgSO4
;
②若阴极析出金属,阳极放出O
2,则电解质的化学式为
Cu(NO3)2、CuSO4
Cu(NO3)2、CuSO4
.

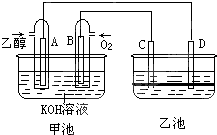 如图甲池和乙池中的四个电极都是惰性材料,乙池溶液分层,上层溶液为盐溶液,呈中性,请根据图示回答下列问题:
如图甲池和乙池中的四个电极都是惰性材料,乙池溶液分层,上层溶液为盐溶液,呈中性,请根据图示回答下列问题: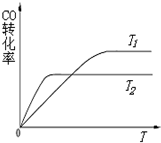 甲醇具有开发和应用广阔的前景.工业上一般采用下列两种途径合成甲醇:
甲醇具有开发和应用广阔的前景.工业上一般采用下列两种途径合成甲醇: