
题目列表(包括答案和解析)

| 元素 | Mn | Fe | |
| 电离 能/kj?mol-1[来源:] |
Ⅰ1 | 717 | 759 |
| Ⅱ2 | 1509 | 1561 | |
| Ⅲ3 | 3248 | 2957 |
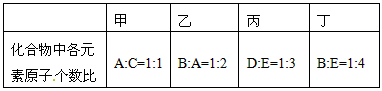
有原子序数依次增大的A、B、C、D、E五种短周期元素,它们可两两组成甲、乙、丙、丁四种化合物,各化合物中原子个数比关系如下表:
甲 乙 丙 丁
化合物中各元素原子个数比 A:C=1:1 B:A=1:2 D:E=1:3 B:E=1:4
其中A、B两种原子的核电荷数之差等于它们的原子最外层电子数之和;B原子最外层电子数比其次外层电子数多两个;在周期表中,C是E的邻族元素,化学性质活泼;D和E位于同一周期,且D和E的原子序数之和为30。
(1)试推断出各元素的符号:A ;B ;C ;D ;E 。
(2)E元素位于周期表中第 周期 族,其最简单离子的结构示意图为 ,E的最高化合价为_____价。
(3)五种元素中,既可以与盐酸反应,又可以与氢氧化钠溶液反应的是____(元素符号),并写出反应的离子方程式:_________________、_________________。




在一百多种化学元素中,非金属占了23种。80%的非金属元素在社会中占重要位置。如C、N、O、Si、Cl等。
(1)氯元素原子最外电子层上有 种能量不同的电子,该元素的简单阴离子核外电子排布式是 。
(2)由氮元素与硅元素组成的物质,可用于制造发动机的耐热部件,因为它属于 晶体,请写出该化合物的化学式 。
(3)下列事实能说明氯与氧两元素非金属性相对强弱的有 。(选填编号)
a.Cl原子最外层电子数比氧多
b.酸性:HCl>H2O
c.ClO2中氯元素为+4价,氧元素为?2价
d.沸点:H2O>HCl
与Cl2相比较,ClO2处理水时被还原成Cl-,不生成有机氯代物等有害物质。工业上可用亚氯酸钠和稀盐酸为原料制备ClO2,反应如下:NaClO2 +HCl ClO2↑+___________________(没有配平)
ClO2↑+___________________(没有配平)
(4)上述方程式中,缺项物质是___________,配平方程式,并在下面补全反应物系数。____NaClO2 +____HCl
(5)该反应中氧化剂和还原剂的物质的量之比是 。生成0.2 mol ClO2转移电子的物质的量为_______ mol。
(6)ClO2对污水中Fe2+、Mn2+、S2-和CN-等有明显的去除效果。某污水中含CN-a mg/L,现用ClO2将CN-氧化,只生成两种无毒气体。处理100m3这种污水,至少需要ClO2 _______ mol 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com