
题目列表(包括答案和解析)
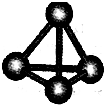 现有A、B、C、D、E、F六种短周期元素,它们的原子序数依次增大,D与E的氢化物分子构型都是V型.A、B的最外层电子数之和与C的最外层电子数相等,A能分别与B、C、D形成电子总数相等的分子,且A与D可形成的化合物,常温下均为液态.
现有A、B、C、D、E、F六种短周期元素,它们的原子序数依次增大,D与E的氢化物分子构型都是V型.A、B的最外层电子数之和与C的最外层电子数相等,A能分别与B、C、D形成电子总数相等的分子,且A与D可形成的化合物,常温下均为液态.

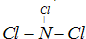
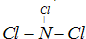
滴定次数 |
0.05000mol?L-1Na2S2O3标准溶液体积/mL | |
| 滴定前刻度 | 滴定后刻度 | |
| 1 | 0.00 | 20.04 |
| 2 | 0.12 | 20.08 |
| 3 | 0.05 | 20.05 |
| 试管编号 | A | B | |
| 步骤 | 1 | 5mL过氧化氢溶液 | 5mL过氧化氢溶液 |
| 2 | 5滴过氧化氢酶溶液 | 5滴 H2O | |
| 3 | 有气泡产生 | 无气泡产生 | |
| 酸 | 电离方程式 | 电离平衡常数Ka |
| CH3COOH | CH3COOH?CH3COO-+H+ | 1.76×10-5 |
| H2S | H2S?H++HS- HS-?H++S2- |
Ka1=9.1×10-8 Ka2=1.1×10-12 |
| H3PO4 | H3PO4?H++H2PO4- H2PO4-?H++HPO42- HPO42-?H++PO43- |
Ka1=7.52×10-3 Ka2=6.23×10-8 Ka3=2.20×10-13 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com