
题目列表(包括答案和解析)
 生物质资源是一种污染小的可再生能源.生物质的主要转化途径及主要产物如图.
生物质资源是一种污染小的可再生能源.生物质的主要转化途径及主要产物如图.| 容器 | 甲 | 乙 | 丙 |
| 反应物投入量 | 1molCO、2molH2 | 1mol CH3OH | 2molCO、4molH2 |
| CH3OH的浓度(mol/L) | c1 | c2 | c3 |
| 反应的能量变化 | 放出Q1 kJ | 吸收Q2 kJ | 放出Q3 kJ |
| 平衡常数 | K1 | K2 | K3 |
| 反应物转化率 | α 1 | α 2 | α 3 |

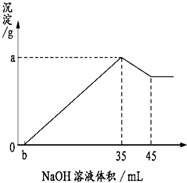 取8g铝土矿(含Al2O3、Fe2O3、SiO2)样品,放入盛有100mL H2SO4溶液的烧杯中,充分反应后过滤,向滤液中加入10mol/L的NaOH溶液,产生沉淀的量与所加NaOH溶液的体积的关系如图所示. 试求:
取8g铝土矿(含Al2O3、Fe2O3、SiO2)样品,放入盛有100mL H2SO4溶液的烧杯中,充分反应后过滤,向滤液中加入10mol/L的NaOH溶液,产生沉淀的量与所加NaOH溶液的体积的关系如图所示. 试求: 如何降低大气中CO2的含量及有效地开发利用碳资源的研究显得尤为紧迫.
如何降低大气中CO2的含量及有效地开发利用碳资源的研究显得尤为紧迫.| 催化剂 |
| 温度/k CO2转化率/% n(H2)/n(CO2) |
500 | 600 | 700 | 800 |
| 1.5 | 45 | 33 | 20 | 12 |
| 2.0 | 60 | 43 | 28 | 15 |
| 3.0 | 83 | 62 | 37 | 22 |
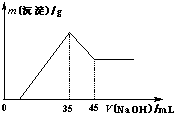 准确称取6.0g铝土矿样品(含Fe2O3),加入100mL稀硫酸中,充分反应后向滤液中加入10mol?L-1NaOH溶液,产生沉淀的质量和加入NaOH溶液体积之间的关系如上图所示.则所用硫酸物质的量浓度为( )
准确称取6.0g铝土矿样品(含Fe2O3),加入100mL稀硫酸中,充分反应后向滤液中加入10mol?L-1NaOH溶液,产生沉淀的质量和加入NaOH溶液体积之间的关系如上图所示.则所用硫酸物质的量浓度为( )湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com