
题目列表(包括答案和解析)
甲醇燃料分为甲醇汽油和甲醇柴油。工业上合成甲醇的方法很多。
(1)一定条件下发生反应:
①CO2(g) +3H2(g) =CH3OH(g)+H2O(g) ? △H1????
②2CO(g) +O2(g) =2CO2(g)?? △H2
③2H2(g)+O2(g) =2H2O(g)????????? △H3
则CO(g) + 2H2(g)  CH3OH(g) 的△H=??????????????? 。
CH3OH(g) 的△H=??????????????? 。
(2)在容积为2L的密闭容器中进行反应: CO(g)+2H2(g) CH3OH(g) ,其他条件不变,在300℃和500℃时,物质的量n(CH3OH) 与反应时间t的变化曲线如图所示。该反应的△H???? 0 (填>、<或=)。
CH3OH(g) ,其他条件不变,在300℃和500℃时,物质的量n(CH3OH) 与反应时间t的变化曲线如图所示。该反应的△H???? 0 (填>、<或=)。

(3)若要提高甲醇的产率,可采取的措施有____________(填字母)。
A.缩小容器体积
B.降低温度
C.升高温度
D.使用合适的催化剂
E.将甲醇从混合体系中分离出来
(4)CH4和H2O在催化剂表面发生反应CH4+H2O CO+3H2,T℃时,向1 L密闭容器中投入1 mol CH4和1 mol H2O(g),5小时后测得反应体系达到平衡状态,此时CH4的转化率为50% ,计算该温度下的平衡常数???? (结果保留小数点后两位数字)。
CO+3H2,T℃时,向1 L密闭容器中投入1 mol CH4和1 mol H2O(g),5小时后测得反应体系达到平衡状态,此时CH4的转化率为50% ,计算该温度下的平衡常数???? (结果保留小数点后两位数字)。
(5)以甲醇为燃料的新型电池,其成本大大低于以氢为燃料的传统燃料电池,目前得到广泛的研究,如图是目前研究较多的一类固体氧化物燃料电池工作原理示意图。回答下列问题:

①B极的电极反应式为????????????????????? 。
②若用该燃料电池做电源,用石墨做电极电解硫酸铜溶液,当电路中转移1mole- 时,实际上消耗的甲醇的质量比理论上大,可能原因是????????????????????? 。
(6)25℃时,草酸钙的Ksp=4.0×10-8,碳酸钙的Ksp=2.5×10-9。向20ml碳酸钙的饱和溶液中逐滴加入8.0×10-4 mol·L-1的草酸钾溶液20ml,能否产生沉淀?????? (填“能”或“否”)。
甲醇燃料分为甲醇汽油和甲醇柴油。工业上合成甲醇的方法很多。
(1)一定条件下发生反应:
①CO2(g) +3H2(g) =CH3OH(g)+H2O(g) △H1
②2CO(g) +O2(g) =2CO2(g) △H2
③2H2(g)+O2(g) =2H2O(g) △H3
则CO(g) + 2H2(g)  CH3OH(g) 的△H= 。
CH3OH(g) 的△H= 。
(2)在容积为2L的密闭容器中进行反应: CO(g)+2H2(g) CH3OH(g) ,其他条件不变,在300℃和500℃时,物质的量n(CH3OH) 与反应时间t的变化曲线如图所示。该反应的△H 0 (填>、<或=)。
CH3OH(g) ,其他条件不变,在300℃和500℃时,物质的量n(CH3OH) 与反应时间t的变化曲线如图所示。该反应的△H 0 (填>、<或=)。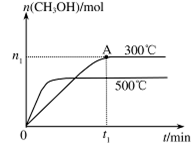
(3)若要提高甲醇的产率,可采取的措施有____________(填字母)。
| A.缩小容器体积 |
| B.降低温度 |
| C.升高温度 |
| D.使用合适的催化剂 |
 CO+3H2,T℃时,向1 L密闭容器中投入1 mol CH4和1 mol H2O(g),5小时后测得反应体系达到平衡状态,此时CH4的转化率为50% ,计算该温度下的平衡常数 (结果保留小数点后两位数字)。
CO+3H2,T℃时,向1 L密闭容器中投入1 mol CH4和1 mol H2O(g),5小时后测得反应体系达到平衡状态,此时CH4的转化率为50% ,计算该温度下的平衡常数 (结果保留小数点后两位数字)。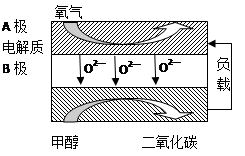
甲醇燃料分为甲醇汽油和甲醇柴油。工业上合成甲醇的方法很多。
(1)一定条件下发生反应:
①CO2(g)+3H2(g)=CH3OH(g)+H2O(g) △H1
②2CO(g)+O2(g) =2CO2(g) △H2
③2H2(g)+O2(g)=2H2O(g) △H3
则CO(g) + 2H2(g)  CH3OH(g) △H= 。
CH3OH(g) △H= 。
(2)在容积为2L的密闭容器中进行反应: CO(g)+2H2(g) CH3OH(g) ,其他条件不变,在300℃和500℃时,物质的量n(CH3OH)与反应时间t的变化曲线如图所示。该反应的△H 0(填>、<或=)。
CH3OH(g) ,其他条件不变,在300℃和500℃时,物质的量n(CH3OH)与反应时间t的变化曲线如图所示。该反应的△H 0(填>、<或=)。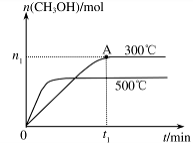
(3)若要提高甲醇的产率,可采取的措施有____________(填字母)。
| A.缩小容器体积 |
| B.降低温度 |
| C.升高温度 |
| D.使用合适的催化剂 |
 CO+3H2,T℃时,向1 L密闭容器中投入1 mol CH4和1 mol H2O(g),5小时后测得反应体系达到平衡状态,此时CH4的转化率为50% ,计算该温度下的平衡常数 (结果保留小数点后两位数字)。
CO+3H2,T℃时,向1 L密闭容器中投入1 mol CH4和1 mol H2O(g),5小时后测得反应体系达到平衡状态,此时CH4的转化率为50% ,计算该温度下的平衡常数 (结果保留小数点后两位数字)。
 CH3OH(g) △H= 。
CH3OH(g) △H= 。 CH3OH(g) ,其他条件不变,在300℃和500℃时,物质的量n(CH3OH)与反应时间t的变化曲线如图所示。该反应的△H 0(填>、<或=)。
CH3OH(g) ,其他条件不变,在300℃和500℃时,物质的量n(CH3OH)与反应时间t的变化曲线如图所示。该反应的△H 0(填>、<或=)。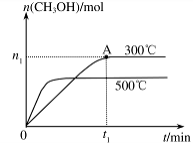
| A.缩小容器体积 |
| B.降低温度 |
| C.升高温度 |
| D.使用合适的催化剂 |
 CO+3H2,T℃时,向1 L密闭容器中投入1 mol CH4和1 mol H2O(g),5小时后测得反应体系达到平衡状态,此时CH4的转化率为50% ,计算该温度下的平衡常数 (结果保留小数点后两位数字)。
CO+3H2,T℃时,向1 L密闭容器中投入1 mol CH4和1 mol H2O(g),5小时后测得反应体系达到平衡状态,此时CH4的转化率为50% ,计算该温度下的平衡常数 (结果保留小数点后两位数字)。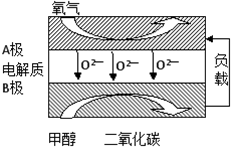
甲醇可作为燃料电池的原料。以CH4和H2O为原料,通过下列反应来制备甲醇。
I:CH4(g)+H2O(g) CO(g)+3H2(g)
△H=+206.0kJ•molˉ1
CO(g)+3H2(g)
△H=+206.0kJ•molˉ1
II:CO(g)+2H2(g) CH3OH(g)
△H=-129.0kJ•molˉ1
CH3OH(g)
△H=-129.0kJ•molˉ1
(1)CH4(g)与H2O(g)反应生成CH3OH(g)和H2(g)的热化学方程式为 。
(2)将1.0mol CH4和1.0mol H2O(g)通入容积为100 L的反应室,在一定条件下发生反应I,测得在一定的压强下CH4的转化率与温度的关系如图。
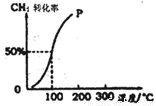
①假设100℃时达到平衡所需构时间为5min,则用H2表示该反应的平均反应速率为 。
②1000C时反应I的平衡常数为 。
(3)在压强为0.1 MPa、温度为300℃条件下,将a molCO与2a mol H2的混合气体在催化剂作用下发生反应II生成甲醇,平衡后将容器舶容积压缩到原来的1/2,其他条件不变,对平衡体系产生的影响是 (填字母序号)。
A.平衡常数K增大 B.正反应速率加快,逆反应速率减慢
C.CH3OH的物质的量增加 D.重新平衡c(H2)/c(CH3OH)减小
(4)甲醇对水质会造成一定的污染,有一种电化学法可消除这种污染,其原理是:通电后,将CO2+氧化成CO3+,然后以CO3+做氧化剂再把水中的甲醇氧化成CO2而净化。若下图装置中的电源为甲醇-空气-KOH溶液的燃料电池,则电池正极的电极反应式: ,该电池工作时,溶液中的OHˉ向 极移动。净化含1mol甲醇的水,燃料电池转移电子 mol。

湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com