乙二酸(HOOC-COOH)俗名草酸,易溶于水,属于二元中强酸,生产和科学实验中有着广泛的用途.草酸晶体的组成可用H
2C
2O
4?xH
2O表示,为了测定x值,进行如下实验:称取Wg草酸晶体,配成100.00mL水溶液,量取25.00mL所配制的草酸溶液置于锥形瓶内,加入适量稀H
2SO
4后,用浓度为amol?L
-1的KMnO
4溶液滴定,
(1)将所发生的反应方程式完成并配平,将完整的化学方程式写在答题卡上.
KMnO
4+H
2C
2O
4+
3H2SO4
3H2SO4
═K
2SO
4+CO
2↑+MnSO
4+
8H2O
8H2O
(2)整个实验过程中不需要的仪器有
c,f
c,f
(填序号).
a.托盘天平(带砝码,镊子)b.酸式滴定管 c.烧瓶 d.100mL容量瓶 e.烧杯 f.漏斗 g.锥形瓶
h.玻璃棒 i.药匙
(3)实验中,标准KMnO
4溶液应盛装在
酸
酸
式滴定管中.滴定终点时溶液的颜色变化为
酸溶液由无色变为浅紫色且半分钟不褪色
酸溶液由无色变为浅紫色且半分钟不褪色
.
(4)在滴定过程中若用去amol?L
-1的KMnO
4溶液VmL,则所配制的草酸溶液的物质的量浓度为
0.1aV
0.1aV
mol?L
-1,由此可计算x的值是
.(用含W、a、V的代数式表示)
(5)该小组同学将0.02mol草酸晶体(H
2C
2O
4?2H
2O)加入到100mL0.2mol/L的NaOH溶液中充分反应,测得反应后溶液呈酸性,则该溶液中各离子浓度由大到小的顺序为
C(Na+)>c(HC2O4-)>c(H+)>c(C2O42-)>c(OH-)
C(Na+)>c(HC2O4-)>c(H+)>c(C2O42-)>c(OH-)
.

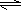 H2CO3+OH-且HCO3-水解程度大于电离程度,故溶液呈碱性
H2CO3+OH-且HCO3-水解程度大于电离程度,故溶液呈碱性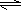 H2CO3+OH-且HCO3-水解程度大于电离程度,故溶液呈碱性
H2CO3+OH-且HCO3-水解程度大于电离程度,故溶液呈碱性