
题目列表(包括答案和解析)
| 实验方案 | 现象及结论 |
(13分)硫代硫酸钠是一种常见的化工原料。将SO2通入按一定比例配成的Na2S和Na2CO3的混合溶液中,便可得到Na2S2O3,其制备反应方程式为: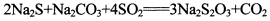 o
o
(1) 在配制混合溶液前先将蒸馏水加热煮沸一段时间后待用,其目的是_______。
(2) 用该方法获得的Naj2O3^H2O晶体中常混有一定量的杂质。某兴趣小组欲对其中所含杂质成分进行探究(不考虑副反应和杂质所带的结晶水)。
【提出假设】
假设1 :晶体中只含>fe2C03杂质
假设2:晶体中只含Na2S杂质
假设3: ____________________________
【查阅资料】
②NhS2O3在中性、碱性溶液中较稳定,而在酸性溶液中能迅速反应: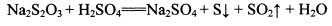
【判断与思考】
某同学取少量制得的晶体溶于足量稀H2SO4,并将产生的气体通入CuSO4溶液中,未见黑色沉淀,据此认为假设2不成立。你认为其结论是否合理?_______ (填“合理”、“不合理”)并说明理由:____________________________
【设计方案进行实验】
基于假设1,完成下表实验方案、现象及结论(仪器自选)。
限选实验试剂: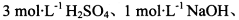 酸性KMnO4溶液、饱和NaHCO3溶液、品红溶液、澄清石灰水
酸性KMnO4溶液、饱和NaHCO3溶液、品红溶液、澄清石灰水
(3) 已知: 。为测定所制得晶体的纯度,该小组以淀粉作指示剂,用
。为测定所制得晶体的纯度,该小组以淀粉作指示剂,用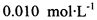 的碘水进行多次取样滴定,测得
的碘水进行多次取样滴定,测得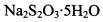 的含量约为102%。若所用试剂及操作均无不当,产生该结果最可能的原因是______________。
的含量约为102%。若所用试剂及操作均无不当,产生该结果最可能的原因是______________。
(13分)硫代硫酸钠是一种常见的化工原料。将SO2通入按一定比例配成的Na2S和Na2CO3的混合溶液中,便可得到Na2S2O3,其制备反应方程式为:
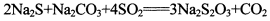 o
o
(1) 在配制混合溶液前先将蒸馏水加热煮沸一段时间后待用,其目的是_______。
(2) 用该方法获得的Naj2O3^H2O晶体中常混有一定量的杂质。某兴趣小组欲对其中所含杂质成分进行探究(不考虑副反应和杂质所带的结晶水)。
假设1 :晶体中只含>fe2C03杂质
假设2:晶体中只含Na2S杂质
假设3: ____________________________
②NhS2O3在中性、碱性溶液中较稳定,而在酸性溶液中能迅速反应:
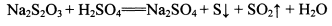
【判断与思考】
某同学取少量制得的晶体溶于足量稀H2SO4,并将产生的气体通入CuSO4溶液中,未见黑色沉淀,据此认为假设2不成立。你认为其结论是否合理?_______ (填“合理”、“不合理”)并说明理由:____________________________
基于假设1,完成下表实验方案、现象及结论(仪器自选)。
限选实验试剂: 酸性KMnO4溶液、饱和NaHCO3溶液、品红溶液、澄清石灰水
酸性KMnO4溶液、饱和NaHCO3溶液、品红溶液、澄清石灰水

(3) 已知: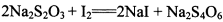 。为测定所制得晶体的纯度,该小组以淀粉作指示剂,用
。为测定所制得晶体的纯度,该小组以淀粉作指示剂,用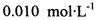 的碘水进行多次取样滴定,测得
的碘水进行多次取样滴定,测得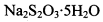 的含量约为102%。若所用试剂及操作均无不当,产生该结果最可能的原因是______________。
的含量约为102%。若所用试剂及操作均无不当,产生该结果最可能的原因是______________。
(13分)硫代硫酸钠是一种常见的化工原料。将SO2通入按一定比例配成的Na2S和Na2CO3的混合溶液中,便可得到Na2S2O3,其制备反应方程式为:
o
(1) 在配制混合溶液前先将蒸馏水加热煮沸一段时间后待用,其目的是_______。
(2) 用该方法获得的Naj2O3^H2O晶体中常混有一定量的杂质。某兴趣小组欲对其中所含杂质成分进行探究(不考虑副反应和杂质所带的结晶水)。
【提出假设】
假设1 :晶体中只含>fe2C03杂质
假设2:晶体中只含Na2S杂质
假设3: ____________________________
【查阅资料】
②NhS2O3在中性、碱性溶液中较稳定,而在酸性溶液中能迅速反应:
【判断与思考】
某同学取少量制得的晶体溶于足量稀H2SO4,并将产生的气体通入CuSO4溶液中,未见黑色沉淀,据此认为假设2不成立。你认为其结论是否合理?_______ (填“合理”、“不合理”)并说明理由:____________________________
【设计方案进行实验】
基于假设1,完成下表实验方案、现象及结论(仪器自选)。
限选实验试剂:酸性KMnO4溶液、饱和NaHCO3溶液、品红溶液、澄清石灰水
(3) 已知:。为测定所制得晶体的纯度,该小组以淀粉作指示剂,用
的碘水进行多次取样滴定,测得
的含量约为102%。若所用试剂及操作均无不当,产生该结果最可能的原因是______________。

(1)①在次氯酸钠溶液中加入固体烧碱形成碱性环境。
①将研磨后的硝酸铁少量多次地加入到上述溶液中,冰浴中反应1h。该反应的离子方程式为_______________________。
②将KOH加入到反应后的溶液中搅拌半小时。静置,抽滤粗产品。该反应的化学方程式为______________________;推测该反应发生的理由是______________________。
④依次用甲苯、乙醇、乙醚洗涤以除去水分和KNO3、KCl、KOH等杂质。
(2)在强碱性溶液中,高铁酸钾能将亚铬酸盐(KCrO2)氧化为铬酸盐(K2CrO4),生成的铬酸盐溶液酸化后,得到的重铬酸钾(K2Cr2O7)用Fe(Ⅱ)的标准溶液滴定,以二苯胺磺酸钠为指示剂。到达滴定终点时,溶液由紫色变为淡绿色(+6价铬转化成+3价格)。现称取5.00g高铁酸钾样品于烧杯中,加入适量氢氧化钾溶液和稍过量的KCrO2,充分反应后,转移到250mL容量瓶中,定容。量取25.00mL溶液,用稀硫酸酸化后,用0.1000 mol·L-1的(NH4)2Fe(SO4)2标准溶液进行滴定,共用去标准溶液33.33mL。
①用离子方程式表示标准溶液显酸性的原因:____________________。
②用离子方程式表示上述滴定反应原理:______________________;如果滴定过程中,剧烈振荡,会使部分亚铁离子被空气中的氧气氧化,导致实验结果偏低。写出亚铁离子在酸性条件下被空气中氧气氧化的离子方程式:______________________。
③上述实验制得的样品中高铁酸钾的质量分数为____________________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com