
题目列表(包括答案和解析)
 17.
17.
(如东启东期中联考14分)如图所示,可视为质点的三物块A、B、C放在倾角为300、长L=2m的固定斜面上,物块与斜面间的动摩擦因数μ=![]() ,A与B紧靠在一起,C紧靠在固定挡板上,三物块的质量分别为mA=0.80kg、mB=0.64kg、mC=0.50kg,其中A不带电,B、C的带电量分别为qB=+4.0×10-5C、qC=+2.0×10-5C且保持不变,开始时三个物块均能保持静止且与斜面间均无摩擦力作用.如果选定两点电荷在相距无穷远处的电势能为0,则相距为r时,两点电荷具有的电势能可表示为
,A与B紧靠在一起,C紧靠在固定挡板上,三物块的质量分别为mA=0.80kg、mB=0.64kg、mC=0.50kg,其中A不带电,B、C的带电量分别为qB=+4.0×10-5C、qC=+2.0×10-5C且保持不变,开始时三个物块均能保持静止且与斜面间均无摩擦力作用.如果选定两点电荷在相距无穷远处的电势能为0,则相距为r时,两点电荷具有的电势能可表示为![]() .现给A施加一平行于斜面向上的力F,使A在斜面上作加速度a=1.5m/s2的匀加速直线运动,经过时间t0,力F变为恒力,当A运动到斜面顶端时撤去力F.已知静电力常量k=9.0×109N?m2/C2,g=10m/s2.求:
.现给A施加一平行于斜面向上的力F,使A在斜面上作加速度a=1.5m/s2的匀加速直线运动,经过时间t0,力F变为恒力,当A运动到斜面顶端时撤去力F.已知静电力常量k=9.0×109N?m2/C2,g=10m/s2.求:
(1)未施加力F时物块B、C间的距离;
(2)t0时间内A上滑的距离;
(3)t0时间内库仑力做的功;
(4)力F对A物块做的总功.
如图所示,整个装置处于静止状态,A、B两球由一根跨过定滑轮的轻绳相连接,A为一带孔小球,穿在光滑固定的竖直杆OD上,且A球与斜面不接触,B与斜面体的接触面光滑,C处滑轮摩擦不计,C、B之间的绳与竖直方向成300角,C、A之间的绳与斜面平行,斜面倾角θ为300,则A、B两球的质量比为 ( )
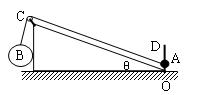
A.![]() B.1
B.1
C.![]() D.
D.![]()


| 高温 |
| c3(H2O) |
| c3(H2) |
| c3(H2O) |
| c3(H2) |
| 1400℃ |
| 约3000℃ |

| t/K | 298 | 398 | 498 | … |
| K | 4.1×106 | K1 | K2 | … |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com