
题目列表(包括答案和解析)
在25mL 0.1mol·L-1NaOH溶液中逐滴加入0.2mol·L-1CH3COOH溶液,溶液pH变化曲线 如图所示,列有关离子浓度的比较正确的是 ( )
A.在A、B间任一点(不含A、B点),溶液中可能有c(Na+)>c(OH-)>c(CH3COO-)>c(H+)
B.在B点,a>12.5,且有c(Na+)=c(CH3COO-)=c(OH-)=c(H+)
C.在C点,c(CH3COO-)>c(Na+)>c(OH-)>c(H+)
D.在D点,c(CH3COO-)+c(CH3COOH)=c(Na+)
在25mL 0.1mol·L-1NaOH溶液中逐滴加入0.2mol·L-1CH3COOH溶液,溶液pH变化曲线如图所示,下列有关离子浓度的比较正确的是
A.在A、B间任一点(不含A、B点),溶液中可能有c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
B.在B点,a>12.5,且有c(Na+)=c(CH3COO-)=c(OH-)=c(H+)
C.在C点,c(CH3COO-)>c(Na+)>c(OH-)>c(H+)
D.在D点,c(CH3COO-)+c(CH3COOH)=c(Na+)
在25ml 0.1mol·L-1NaOH溶液中逐滴加入0.2mol·L-1CH3COOH溶液,溶液pH变化曲线如图所示,下列有关离子浓度的比较正确的是
A.在A、B间任一点(不含A、B点),溶液中可能有
C(Na+)> C(CH3COO-)> C(OH-)> C(H+)
B.在B点,a>12.5,且有C(Na+)= C(CH3COO-)= C(OH-)= C(H+)
C.在C点,C(CH3COO-)> C(Na+)> C(OH-)> C(H+)
D.在D点,C(CH3COO-)+ C(CH3COOH)= C(Na+)
在25ml 0.1mol·L-1NaOH溶液中逐滴加入0.2mol·L-1CH3COOH溶液,溶液pH变化曲线如图所示,下列有关离子浓度的比较正确的是

A.在A、B间任一点(不含A、B点),溶液中可能有C(Na+) > C(CH3COO-) > C(OH-) > C(H+)
B.在B点,a>12.5,且有C(Na+) = C(CH3COO-) = C(OH-) = C(H+)
C.在C点,C(CH3COO-) > C(Na+) > C(OH-) > C(H+)
D.在D点,C(CH3COO-) + C(CH3COOH) = C(Na+)
在25mL 0.1mol·L-1NaOH溶液中逐滴加入0.2mol·L-1CH3COOH溶液,溶液pH变化曲线如图所示,下列有关离子浓度的比较正确的是
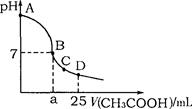
A.在A、B间任一点(不含A、B点),溶液中可能有c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
B.在B点,a>12.5,且有c(Na+)=c(CH3COO-)=c(OH-)=c(H+)
C.在C点,c(CH3COO-)>c(Na+)>c(OH-)>c(H+)
D.在D点,c(CH3COO-)+c(CH3COOH)=c(Na+)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com