
题目列表(包括答案和解析)
| 所加试剂 | 预期现象和结论 |
| 试管A中加足量① ; 试管B中加1%品红溶液; 试管C中加② . |
若A中溶液变蓝色,B中溶液不退色,C中溶液变浑浊.则消毒液部分变质; ③ 则消毒液未变质; ④ 则消毒液完全变质. |
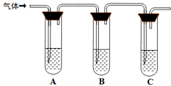
| 所加试剂 | 预期现象和结论 |
| 试管A中加足量①______; 试管B中加1%品红溶液; 试管C中加②______. | 若A中溶液变蓝色,B中溶液不退色,C中溶液变浑浊.则消毒液部分变质; ③______则消毒液未变质; ④______则消毒液完全变质. |
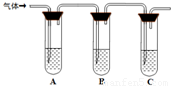
(18分)Na2S2O3是重要的化工原料,易溶于水。在中性或碱性环境中稳定。
I.制备Na2S2O3?5H2O
反应原理:Na2SO3(aq)+S(s) Na2S2O3(aq)
Na2S2O3(aq)
实验步骤:
①称取15g Na2SO3加入圆底烧瓶中,再加入80ml蒸馏水。另取5g研细的硫粉,用3ml 乙醇润湿,加入上述溶液中。
②安装实验装置(如图所示,部分加持装置略去),水浴加热,微沸60分钟。
③趁热过滤,将滤液水浴加热浓缩,冷却析出Na2S2O3?5H2O,经过滤,洗涤,干燥,得到产品。
回答问题:
(1)硫粉在反应前用乙醇润湿的目的是 。
(2)仪器a的名称是 ,其作用是 。
(3)产品中除了有未反应的Na2SO3外,最可能存在的无机杂质是 ,检验是否存在该杂质的方法是 。
(4)该实验一般控制在碱性环境下进行,否则产品发黄,用离子方程式表示其原因:
。
II.测定产品纯度
准确称取Wg产品,用适量蒸馏水溶解,以淀粉作指示剂,用0.1000 mol?L?1碘的标准溶液滴定。
反应原理为:2S2O32?+I2=S4O62-+2I?
(5)滴定至终点时,溶液颜色的变化: 。
(6)滴定起始和终点的液面位置如图,则消耗碘的标准溶液体积为 mL。产品的纯度为(设Na2S2O3?5H2O相对分子质量为M) 。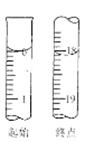
III.Na2S2O3的应用
(7)Na2S2O3还原性较强,在溶液中易被Cl2氧化成SO42?,常用作脱氧剂,该反应的离子方程式为 。
 Na2S2O3(aq)
Na2S2O3(aq)

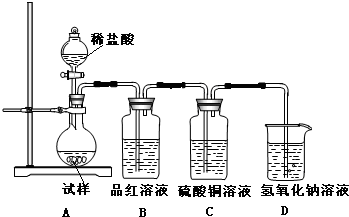 为探究亚硫酸钠的热稳定性,某研究性学习小组将无水亚硫酸钠隔绝空气加热,并利用受热后的固体试样和图所示的实验装置进行实验.请回答下列有关问题:
为探究亚硫酸钠的热稳定性,某研究性学习小组将无水亚硫酸钠隔绝空气加热,并利用受热后的固体试样和图所示的实验装置进行实验.请回答下列有关问题:
| ||
| ||
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com