
题目列表(包括答案和解析)
(13分)(1)配平氧化还原反应方程式:平衡时
__ C2O42-+__MnO4-+__H+= __CO2+__Mn2
__CO2+__Mn2 ++__H2O
++__H2O
(2)称取6.0 g含H2C2O4·2H2O、KHC2O4和K2SO4的试样,加水溶解,配成250mL溶液。量取两份此溶液各25mL,分别置于两个锥形瓶中。
(附相对原子质量:H--1 C--12 S--28 O--16 K--39 )
①第一份溶液中加入酚酞试液,滴加0.25mol/L NaOH溶液至20mL时,溶液由无色变为浅红色。该溶液被中和的H+的物质的量为 mol。
②第二份溶液中滴加 0.10mol/L 的酸性高锰酸钾溶液至 16mL 时反应完全,此时溶液颜色由 变为 。该溶液中还原剂的物质的量为 mol。
③原试样中H2C2O4·2H2O的质量分数为 。
 __CO2+__Mn2
__CO2+__Mn2 ++__H2O
++__H2O| 弱酸化学式 | CH3COOH | HCN | H2CO3 |
| 电离平衡常数(25℃) | 1.8×l0_5 | 4.9×l0_10 | K1=4.3×l0_7 K2=5.6×l0_11 |
| A.等物质的量浓度的各溶液pH关系为:pH(NaCN)>pH(Na2CO3)>pH(CH3COONa) |
| B.a mol·L—1 HCN溶液与b mol·L—1 NaOH溶液等体积混合后,所得溶液中c(Na+)>c(CN-),则a一定大于b |
| C.冰醋酸中逐滴加水,则溶液的导电性、醋酸的电离度、pH均先增大后减小 |
| D.NaHCO3和Na2CO3混合溶液中,一定存在c(Na+)+ c(H+)=c(OH-)+ c(HCO3-) +2c(CO32-) |
已知25℃时有关弱酸的电离平衡常数:
| 弱酸化学式 | CH3COOH | HCN | H2CO3 |
| 电离平衡常数(25℃) | 1.8×l0_5 | 4.9×l0_10 | K1=4.3×l0_7 K2=5.6×l0_11 |
(15分)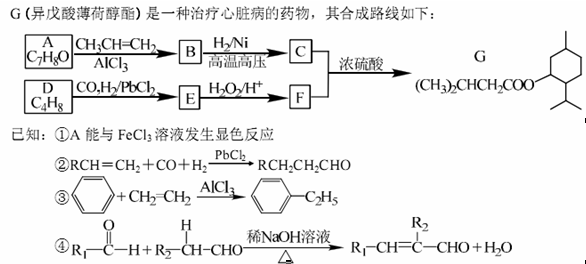
(1) A的名称为____
(2) G中含氧官能团名称为____
(3) D的分子中含有____种不同化学环境的氢原子
(4) E与新制的氢氧化铜反应的化学方程式为____
(5)写出符合下列条件的A的所有同分异构体的结构简式:____
A.分子中有6个碳原子在一条直线上:b.分子中含--OH
(6)正戊醇可用作香料、橡胶促进剂等,写出以乙醇为原料制备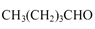 的合成路线流
的合成路线流
程图(无机试剂任用)。合成路线流程示意图示例如下: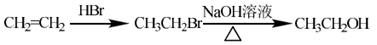
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com