
题目列表(包括答案和解析)
(14分)工业制硝酸的主要反应是4NH3(g)+5O2(g)  4NO(g)+6H2O(g)ΔH=-akJ/mol(a﹥0)
4NO(g)+6H2O(g)ΔH=-akJ/mol(a﹥0)
(1)如果将4molNH3和5molO2放入容器中,达到平衡时,放出热量0.8akJ,则反应时转移的电子数为
mol
(2)若其他条件不变,下列关系图中错误的是 (选填序号)
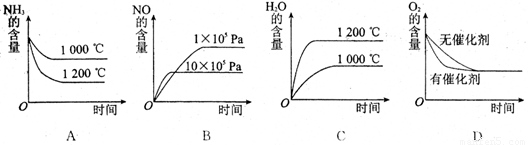
(3)t℃时,在容积固定的密闭容器中发生上述反应,容器内各物质的浓度如下表
|
浓度(mol/L) 时间(min) |
c(NH3) |
c(O2) |
c(NO) |
c(H2O) |
|
起 始 |
4.0 |
5.5 |
0 |
0 |
|
第2min |
3.2 |
x |
0.8 |
1.2 |
|
第4min |
2.0 |
3.0 |
2.0 |
3.0 |
|
第6min |
2.0 |
3.0 |
2.0 |
3.0 |
①反应在第2mim到第4mim时,反应速率v(O2)=
②第2min时改变了条件,改变的条件可能是
A.升高温度 B.使用了催化剂 C.减小压强 D.增加了生成物
③在相同的温度下,起始向容器中加入NH3、O2、NO和H2O(g)的浓度都为1mol/L,则该反应将向 _______方向进行(填“正反应”.“逆反应”.“不移动”)
(4)工业上用水吸收二氧化氮生产硝酸,生成的NO2气体经过多次氧化、吸收的循环操作使其充分转化为硝酸(假定上述过程中无其它损失),现有23吨NO2经过2次氧化吸收得到20℅的稀硝酸 吨。
(5)成品硝酸的浓度为60%~70%,为了制浓硝酸,常用Mg(NO3)2作吸水剂,然后进行蒸馏,不用CaCl2或MgCl2作吸水剂的原因是__________________________________________
(14分)工业上常用铁质容器盛装冷浓硫酸。为研究铁质材料与热浓硫酸的反应,某学习小组进行了以下探究活动:
[探究一]
(1)将已去除表面氧化物的铁钉(碳素钢)放入冷浓硫酸中,10分钟后移入硫酸铜溶液中,片刻后取出观察,铁钉表面无明显变化,其原因是 。
(2)另称取铁钉6.0g放入15.0mL浓硫酸中,加热,充分应后得到溶液X并收集到气体Y。
①甲同学认为X中除Fe3+外还可能含有Fe2+。若要确认其中的Fe2+,应选用 (选填序号)。
a.KSCN溶液和氯水 b.铁粉和KSCN溶液 c..浓氨水 d.酸性KMnO4溶液
②乙同学取336mL(标准状况)气体Y通入足量溴水中,发生反应:
SO2+Br2+2H2O=2HBr+H2SO4
然后加入足量BaCl2溶液,经适当操作后得干燥固体2.33g。由于此推知气体Y中SO2的体积分数为 。
[探究二]
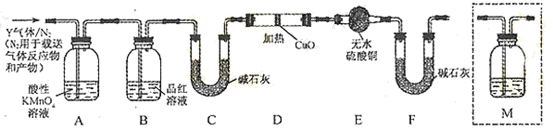
分析上述实验中SO2体积分数的结果,丙同学认为气体Y中还可能含少量的H2和Q气体。为此设计了下列探究实验装置(图中夹持仪器省略)。
(3)装置B中试剂的作用是 。
(4)认为气体Y中还含有Q的理由是 (用化学方程式表示)。
(5)为确认Q的存在,需在装置中添加M于 (选填序号)。
a. A之前 b.A-B间 c.B-C间 d.C-D间
(6)如果气体Y中含有H2,预计实验现象应是 。
(14分)工业上常用铁质容器盛装冷浓硫酸。为研究铁质材料与热浓硫酸的反应,某学习小组进行了以下探究活动:
[探究一]
(1)将已去除表面氧化物的铁钉(碳素钢)放入冷浓硫酸中,10分钟后移入硫酸铜溶液中,片刻后取出观察,铁钉表面无明显变化,其原因是 。
(2)另称取铁钉6.0g放入15.0mL浓硫酸中,加热,充分应后得到溶液X并收集到气体Y。
①甲同学认为X中除Fe3+外还可能含有Fe2+。若要确认其中的Fe2+,应选用 (选填序号)。
a.KSCN溶液和氯水 b.铁粉和KSCN溶液 c..浓氨水 d.酸性KMnO4溶液
②乙同学取336mL(标准状况)气体Y通入足量溴水中,发生反应:
SO2+Br2+2H2O=2HBr+H2SO4
然后加入足量BaCl2溶液,经适当操作后得干燥固体2.33g。由于此推知气体Y中SO2的体积分数为 。
[探究二]
分析上述实验中SO2体积分数的结果,丙同学认为气体Y中还可能含少量的H2和Q气体。为此设计了下列探究实验装置(图中夹持仪器省略)。
(3)装置B中试剂的作用是 。
(4)认为气体Y中还含有Q的理由是 (用化学方程式表示)。
(5)为确认Q的存在,需在装置中添加M于 (选填序号)。
a. A之前 b.A-B间 c.B-C间 d.C-D间
(6)如果气体Y中含有H2,预计实验现象应是 。
(14分). 复印机使用的墨粉主要成分是Fe3O4,下图是氧化沉淀法生产Fe3O4的工艺:

已知:① 工业绿矾中FeSO4的含量为52.5%,其中的杂质不参与反应;
② Fe(OH)2+2Fe(OH)3=Fe3O4·4H2O
③ 12.16﹡1000﹡52.5%=6384, 6384/152=42请回答下列问题:
(1)铁的常见氧化物有 ;
(2)Fe3O4与稀硝酸反应的离子方程式是 ,检验反应后的溶液中含Fe3+的方法 ;
(3)在工艺流程中,通入适量空气“氧化”时的化学方程式是: ;
(4)生产中可获得的副产品是 ,提取该副产品的操作顺序是 (填写序号)
a.过滤 b.加热浓缩 c.冷却 d.结晶 e.洗涤
(5)在生产过程中,若工业绿矾的投料速率是12.16 kg/h,为使产品较纯,鼓入空气的速率应为 L/h(假设反应在标准状态下进行,空气中O2占20%)。
(14分). 复印机使用的墨粉主要成分是Fe3O4,下图是氧化沉淀法生产Fe3O4的工艺:
已知:① 工业绿矾中FeSO4的含量为52.5%,其中的杂质不参与反应;
② Fe(OH)2+2Fe(OH)3=Fe3O4·4H2O
③ 12.16﹡1000﹡52.5%=6384, 6384/152=42请回答下列问题:
(1)铁的常见氧化物有 ;
(2)Fe3O4与稀硝酸反应的离子方程式是 ,检验反应后的溶液中含Fe3+的方法 ;
(3)在工艺流程中,通入适量空气“氧化”时的化学方程式是: ;
(4)生产中可获得的副产品是 ,提取该副产品的操作顺序是 (填写序号)
a.过滤 b.加热浓缩 c.冷却 d.结晶 e.洗涤
(5)在生产过程中,若工业绿矾的投料速率是12.16 kg/h,为使产品较纯,鼓入空气的速率应为 L/h(假设反应在标准状态下进行,空气中O2占20%)。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com