
题目列表(包括答案和解析)
|
R元素的原子核外有三个电子层,M层电子数是K层的3倍.下列判断错误的是 | |
| [ ] | |
A. |
R元素处于第三周期ⅥA族 |
B. |
R元素的最低化合价为-2价 |
C. |
R原子的核外共有14个电子 |
D. |
R元素为非金属元素 |
图中C至L分别表示反应中的一种常见物质,E、F、I在通常情况下是气体单质,其中E有刺激性气味,X、Y是常见的金属单质.W是由甲、乙元素按1∶1的比例组成的,其中甲元素的原子的M层电子数是K层的一半,乙元素的原子最外层电子数是次外层电子数的3倍.(参加反应的水和生成的水已从图中略去)
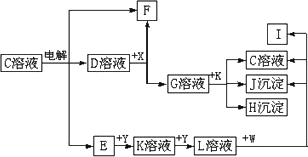
填写空白:
(1)E是________(化学式),Y元素在周期表中的位置是________.
(2)写出K+G→H+J+C的离子方程式________.
(3)写出W+L→J+C+I的化学方程式________.
(4)设计实验分离H和J(写出所用试剂和操作方法):________.
| X | L层电子数是K层电子数的3倍 |
| Y | 核外电子层数等于原子序数 |
| Z | L层电子数是K层和M层电子数之和 |
| W | 最外层电子数是次外层电子数的2.5倍 |
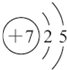
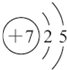
| ||
| ||
| ||
| ||
(11分)有A、B、C、D、E五种短周期元素,它们的核电荷数按C、A、B、D、E的顺序依次增大。C、D都能分别与A按原子个数比为1∶1或2∶1形成化合物。CB可与EA2反应生成C2A和气态物质EB4。E的M层电子数是K层电子数的2倍。
(1)写出A、B、E元素的名称A:__________;B:_______________; E : ;
(2)写出电子式D2A2__________;
(3)写出D单质与CuSO4溶液反应的离子方程式_________________________
(4)C2A是由__________键形成的________分子 (填“极性”或“非极性”);中心原子杂化类型是 ,分子立体构型是 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com