
题目列表(包括答案和解析)
方案一:检验褪色后溶液的酸碱性。
方案二:测定反应前溴水中Br2的物质的量和反应后Br-的物质的量。
(1)方案一是否可行?,_________理由是_______________________________________。
(2)假设测得反应前溴水中Br2的物质的量为a mol,若测得反应后n(Br-)=_________mol,则说明溴水与乙醛发生了取代反应;若测得反应后n(Br-)=_________mol,则说明溴水与乙醛发生了加成反应;若测得反应后n(Br-)=_________mol,则说明溴水将乙醛氧化为乙酸。
(3)按物质的量之比1∶5配制1 000 mL KBrO3KBr溶液,该溶液在酸性条件下完全反应可生成0.5 mol Br2。取反应后的溶液10 mL,加入足量乙醛溶液使其褪色,然后将所得溶液稀释为100 mL,准确量取其中的10 mL,加入过量AgNO3溶液,过滤、洗涤、干燥后称量得到固体0.188 g。若已知CH3COOAg易溶解于水,试通过计算判断溴水与乙醛发生反应的类型为_________。
(4)写出上述测定过程中三个反应的离子方程式。
①KBrO3与KBr在酸性条件下的反应:_____________________________________________;
②溴水与乙醛反应:_____________________________________________________________;
③测定Br-含量的反应:__________________________________________________________。
(10分)实验室需要480 mL 0.4 mol·L-1的NaCl溶液,有如下操作步骤:
①把称量好的NaCl晶体放入小烧杯中,加适量蒸馏水溶解。
②把①所得溶液小心转入一定容积的容量瓶中。
③继续向容量瓶中加蒸馏水至液面距刻度线1 cm~2 cm处,改用胶头滴管小心滴加蒸馏水至溶液凹液面与刻度线相切。
④用少量蒸馏水洗涤烧杯和玻璃棒2~3次,每次洗涤的液体都小心转入容量瓶,并轻轻摇匀。
⑤将容量瓶瓶塞塞紧,充分摇匀。
请填写下列空白:
(1)操作步骤的正确顺序为(填序号)________。
(2)实验室有如下规格的容量瓶:①100 mL,②250 mL,③500 mL,④1 000 mL,本实验选用________(填序号)。
(3)本实验用到的基本实验仪器除容量瓶、玻璃棒外还有:________________________。
(4)需要使用玻璃棒的操作有________(填序号),其作用为________________________。
(5)误差分析:(填“偏高”、“偏低”或“无影响”)
①称量NaCl时,物码倒置(1 g以下用游码):________。
②某同学观察液面的情况如图所示:__________________。
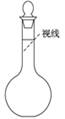
③没有进行操作步骤④:________。
④加蒸馏水时不慎超过了刻度线,立即用胶头滴管将多余的水吸出:________。
⑤容量瓶原来有少量水:____________。
(10分)用中和滴定法测定某烧碱样品的纯度。有以下步骤:
(1)配制待测液:用5.00 g含有少量杂质(杂质不与盐酸反应)的固体烧碱样品配制1 000 mL溶液。除烧杯外,还需要的玻璃仪器有___________、 、 _。
(2)滴定:
①盛装0.1000mol·L-1盐酸标准液应该使用_______________式滴定管。
②滴定时双眼应 。
③有关数据记录如下:
| 测定序号 | 待测溶液的体积/mL | 所耗盐酸标准液的体积/mL | |
| 滴定前 | 滴定后 | ||
| 1 | 20.00 | 0.50 | 20.78 |
| 2 | 20.00 | 1.20 | 21.32 |
(3)计算纯度:烧碱样品的纯度是_________________。
(4)误差讨论(选填“偏高”“偏低”或“无影响”):
①用蒸馏水冲洗锥形瓶,则会使测定结果___________;
②在滴定过程中不慎将数滴酸液滴在锥形瓶外,则会使测定结果___________;
③读数时,滴定前仰视,滴定后俯视,则会使测定结果___________。
某学生欲配制6.0 mol·L-1的H2SO4 1 000 mL,实验室有三种不同浓度的硫酸:①480 mL 0.5 mol·L-1 的硫酸;②150 mL 25%的硫酸(ρ=1.18 g·mL-1);③足量的18 mol·L-1 的硫酸。有三种规格的容量瓶:250 mL、500 mL、1 000 mL。老师要求把①②两种硫酸全部用完,不足的部分由③来补充。
请回答下列问题:
(1)实验所用25%的硫酸的物质的量浓度为________mol·L-1(保留1位小数)。
(2)配制该硫酸溶液应选用容量瓶的规格为________mL。
(3)配制时,该同学的操作顺序如下,请将操作步骤B、D补充完整。
A.将①②两溶液全部在烧杯中混合均匀;
B.用量筒准确量取所需的 18 mol·L-1的浓硫酸 mL,沿玻璃棒倒入上述混合液中。
并用玻璃棒搅拌,使其混合均匀;
C.将混合均匀的硫酸沿玻璃棒注入所选的容量瓶中;
D.______________________________________;
E.振荡,继续向容量瓶中加水,直到液面接近刻度线1~2 cm处;
F.改用胶头滴管加水,使溶液的凹液面恰好与刻度线相切;
G.将容量瓶盖紧,振荡,摇匀。
(4)如果省略操作D,对所配溶液浓度有何影响?________(填“偏大”、“偏小”或“无影响”)。
(5)进行操作C前还需注意________________。
(10分)用中和滴定法测定某烧碱样品的纯度。有以下步骤:
(1)配制待测液:用5.00 g含有少量杂质(杂质不与盐酸反应)的固体烧碱样品配制1 000 mL溶液。除烧杯外,还需要的玻璃仪器有___________、 、 _。
(2)滴定:
①盛装0.1000 mol·L-1盐酸标准液应该使用_______________式滴定管。
②滴定时双眼应 。
③有关数据记录如下:
|
测定序号 |
待测溶液的体积/mL |
所耗盐酸标准液的体积/mL |
|
|
滴定前 |
滴定后 |
||
|
1 |
20.00 |
0.50 |
20.78 |
|
2 |
20.00 |
1.20 |
21.32 |
(3)计算纯度:烧碱样品的纯度是_________________。
(4)误差讨论(选填“偏高”“偏低”或“无影响”):
①用蒸馏水冲洗锥形瓶,则会使测定结果___________;
②在滴定过程中不慎将数滴酸液滴在锥形瓶外,则会使测定结果___________;
③读数时,滴定前仰视,滴定后俯视,则会使测定结果___________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com