
题目列表(包括答案和解析)
下列化学实验的方法和结果都正确的是
A.CH3COONa?3H2O与碱石灰混合加热可以很快制得大量的CH4
B.向碘水形成的x悬浊液中通入H2S气体至反应完全,过滤可得氢碘酸
C.将稀硫酸和乙醇的混合物加热,迅速升温至170 ℃,则可制得乙烯
D.将甲烷气体与溴蒸气混合光照后,可制得纯净的二溴甲烷
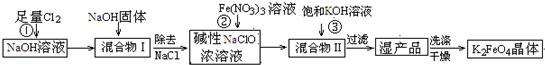
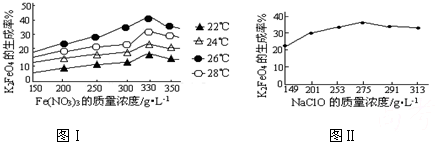

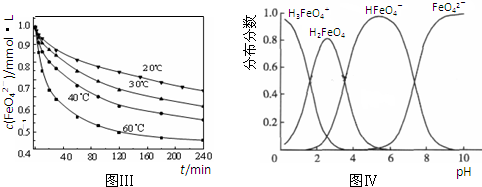


 4Fe(OH)3+8OH-+3O2↑.在提纯K2FeO4时采用重结晶、洗涤、低温烘干的方法,则洗涤剂最好选用______溶液(填序号).
4Fe(OH)3+8OH-+3O2↑.在提纯K2FeO4时采用重结晶、洗涤、低温烘干的方法,则洗涤剂最好选用______溶液(填序号).

 4Fe(OH)3+8OH-+3O2↑.在提纯K2FeO4时采用重结晶、洗涤、低温烘干的方法,则洗涤剂最好选用______溶液(填序号).
4Fe(OH)3+8OH-+3O2↑.在提纯K2FeO4时采用重结晶、洗涤、低温烘干的方法,则洗涤剂最好选用______溶液(填序号).


 4Fe(OH)3+8OH-+3O2↑.在提纯K2FeO4时采用重结晶、洗涤、低温烘干的方法,则洗涤剂最好选用
4Fe(OH)3+8OH-+3O2↑.在提纯K2FeO4时采用重结晶、洗涤、低温烘干的方法,则洗涤剂最好选用
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com