
题目列表(包括答案和解析)
(10分)蛋壳的主要成分是CaCO3,其次是SiO2、MgCO3及色素等杂质,测定蛋壳中钙的含量时常涉及如图操作步骤,其中最后滴定操作是用标准酸性高锰酸钾溶液滴定生成的草酸,通过钙与草酸的定量关系,可间接求出钙的含量。
资料支持:①草酸的电离方程式为H2C2O4 H++HC2O ;
②滴定过程的反应为H2C2O4+MnO +H+―→Mn2++CO2↑+H2O(未配平);
③Ksp(CaC2O4)=2.510-9,Ksp(MgC2O4)=8.610-5
根据以上材料回答下列问题:
(1)样品溶于盐酸后得到的滤渣主要是________。
(2)①②操作时,加入饱和(NH4)2C2O4溶液和氨水的作用是_______________;
(3)实验中通常用0.1 molL-1草酸铵溶液洗涤沉淀。若实验时用水洗涤沉淀,且每次洗涤时消耗草酸铵溶液和水的体积相同,则每次洗涤时用草酸铵溶液洗涤与用水洗涤损失的质量之比为____________;
(4)达到滴定终点的特征为;
(5)若考虑MgCO3的存在,则此法求得的钙含量略__________实际值(填>、=、<)
(10分)蛋壳的主要成分是CaCO3,其次是SiO2、MgCO3及色素等杂质,测定蛋壳中钙的含量时常涉及如图操作步骤,其中最后滴定操作是用标准酸性高锰酸钾溶液滴定生成的草酸,通过钙与草酸的定量关系,可间接求出钙的含量。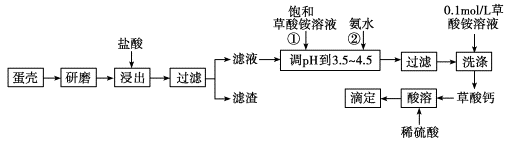
资料支持:①草酸的电离方程式为H2C2O4 H++HC2O ;
②滴定过程的反应为H2C2O4+MnO +H+―→Mn2++CO2↑+H2O(未配平);
③Ksp(CaC2O4)=2.510-9,Ksp(MgC2O4)=8.610-5
根据以上材料回答下列问题:
(1)样品溶于盐酸后得到的滤渣主要是________。
(2)①②操作时,加入饱和(NH4)2C2O4溶液和氨水的作用是_______________;
(3)实验中通常用0.1 molL-1草酸铵溶液洗涤沉淀。若实验时用水洗涤沉淀,且每次洗涤时消耗草酸铵溶液和水的体积相同,则每次洗涤时用草酸铵溶液洗涤与用水洗涤损失的质量之比为____________;
(4)达到滴定终点的特征为;
(5)若考虑MgCO3的存在,则此法求得的钙含量略__________实际值(填>、=、<)
(10分)蛋壳的主要成分是CaCO3,其次是SiO2、MgCO3及色素等杂质,测定蛋壳中钙的含量时常涉及如图操作步骤,其中最后滴定操作是用标准酸性高锰酸钾溶液滴定生成的草酸,通过钙与草酸的定量关系,可间接求出钙的含量。

资料支持:①草酸的电离方程式为H2C2O4 H++HC2O ;
②滴定过程的反应为H2C2O4+MnO +H+―→Mn2++CO2↑+H2O(未配平);
③Ksp(CaC2O4)=2.510-9,Ksp(MgC2O4)=8.610-5
根据以上材料回答下列问题:
(1)样品溶于盐酸后得到的滤渣主要是________。
(2)①②操作时,加入饱和(NH4)2C2O4溶液和氨水的作用是_______________;
(3)实验中通常用0.1 molL-1草酸铵溶液洗涤沉淀。若实验时用水洗涤沉淀,且每次洗涤时消耗草酸铵溶液和水的体积相同,则每次洗涤时用草酸铵溶液洗涤与用水洗涤损失的质量之比为____________;
(4)达到滴定终点的特征为;
(5)若考虑MgCO3的存在,则此法求得的钙含量略__________实际值(填>、=、<)
(8分)蛋壳的主要成分是CaCO3,其次是MgCO3、蛋白质、色素等。为测定其中钙的含量,洗净蛋壳,加水煮沸约5 min,置于蒸发皿中用小火烤干,研细。
(1) 称取0.3 g(设为0.3000g)蛋壳样品,置于锥形瓶中逐滴加入已知浓度c(HCl)的盐酸40.00 mL,而后用小火加热使之溶解,冷却后加2滴甲基橙溶液,用已知浓度c(NaOH)回滴,消耗V(NaOH) L达终点。
① (2分)写出计算钙含量的算式。
② (1分)计算得到的是钙的含量吗?
③ (1分)是原蛋壳中钙的含量吗?
(2) 称取0.3 g(设为0.3000 g)蛋壳样品,用适量强酸溶解,然后加(NH4)2C2O4得沉淀,经过滤、洗涤,沉淀溶于H2SO4溶液,再用已知浓度c(KMnO4)滴定(生成Mn2+和CO2),消耗V(KMnO4)L达到终点。
① (2分)写出计算钙含量的算式;
② (2分)此法求得的钙含量略低于上法。为什么?

湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com