
题目列表(包括答案和解析)

根据上述数据,完成下列填空:?
(1)实验1,反应在10~20 min时间内A的平均反应速率为______________mol·(L·min)-1。
(2)实验2,A的初始浓度c2=_______mol·L-1,反应经20 min就达到平衡,可推测实验2中还隐含的条件是_____________________。
(3)设实验3的反应速率为v3,实验1的反应速率为v1,则v3_______v1(填“>”“=”或“<”),且c3_______1.0 mol·L-1(填“>”“=”或“<”)。
(4)比较实验4和实验1,可推测该反应是_______(填“吸热”“放热”)反应。理由是_________________________________________________ 。?
( )
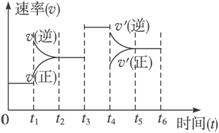
6
A.该曲线中处于平衡状态的时间段共有3个
B.C的百分含量最高的时间段是0—t1
C.t1时刻可能是体系升温引起的变化
D.t4时刻可能是容器扩大体积引起的变化
(1)下列叙述能说明该反应一定达到化学平衡状态的是
A.3v(B)生成=2v(D)生成
B.各物质的浓度保持不变
C.容器的压强保持不变
D.C的质量保持不变
E.A、B、C、D的浓度之比为1∶3∶2∶2
(2)若起始充入1 mol A、3 mol B,建立平衡后A的浓度为w mol·L-1,保持相同的温度和体积,若起始充入0.5 mol A、1.5 mol B, ___________mol C, ___________ mol D。达到平衡时A的浓度仍为w mol·L-1。
(3)若维持温度不变,在容积可变的密闭容器中,逐步增大体系的压强,在不同压强下建立平衡后,D物质的物质的量浓度见下表(在增大压强的过程中无其他副反应发生)
压强/Pa | 4×105 | 6×105 | 1×106 | 2×106 |
D/mol·L-1 | 0.08 | 0.12 | 0.20 | 0.45 |
压强从1×106Pa增大到2×106Pa时,平衡___________移动(填“正向”“逆向”或“不”)。在2×106Pa下,向该体系中充入1 mol A、3 mol B,建立平衡时C的物质的量为a mol,若相同条件下,再充入3 mol A和9 mol B,建立平衡时C的物质的量为____________mol。
在密闭容器中加入等浓度的CO与H2O,T ℃时发生如下反应:CO(g)+H2O(g) ![]() CO2(g)+H2(g) ΔH <0已知CO的浓度变化如图所示。
CO2(g)+H2(g) ΔH <0已知CO的浓度变化如图所示。

⑴从0~4 min,该反应的平均速率v(CO)= mol/(L·min)。该反应的平衡为 。
⑵为了增大CO的转化率,可以采取的措施有 。
a.增大反应物中CO的浓度
b.降低反应温度
c.将密闭容器体积压缩至一半
d.加入适宜的催化剂
⑶若不改变反应温度和反应物中CO的起始浓度,使CO的转化率达到90%,则水蒸气的起始浓度至少为 mol/L。
在密闭容器中加入等浓度的CO与H2O,T ℃时发生如下反应:CO(g)+H2O(g) ![]() CO2(g)+H2(g) ΔH <0已知CO的浓度变化如图所示。
CO2(g)+H2(g) ΔH <0已知CO的浓度变化如图所示。

⑴从0~4 min,该反应的平均速率v(CO)= mol/(L·min)。该反应的平衡为 。
⑵为了增大CO的转化率,可以采取的措施有 。
a.增大反应物中CO的浓度
b.降低反应温度
c.将密闭容器体积压缩至一半
d.加入适宜的催化剂
⑶若不改变反应温度和反应物中CO的起始浓度,使CO的转化率达到90%,则水蒸气的起始浓度至少为 mol/L。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com