已知X、Y、Z、W为四种短周期元素,其原子序数依次增大,且由这些元素所组成的单质在常温下均呈气态.X、Y、W处于不同周期,且在一定条件下其单质能发生反应:X
2+Y
2→甲,X
2+W
2→乙,甲、乙可化合生成离子化合物丙.试回答下列问题:
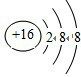
(1)W元素在周期表中的位置是
第三周期ⅦA族
第三周期ⅦA族
;甲的空间结构为
三角锥形
三角锥形
.
(2)丙的水溶液呈酸性,用离子方程式表示其原因:
NH
4++H
2O

NH
3?H
2O+H
+NH
4++H
2O

NH
3?H
2O+H
+.
(3)X、Z可组成四原子化合物丁,丁是一种二元弱酸,写出丁在水中的电离方程式:
H
2O
2
H
++HO
2-HO
2-
H
++O
22-H
2O
2
H
++HO
2-HO
2-
H
++O
22-;X、Y组成的液态化合物Y
2X
4 16克与足量丁反应生成Y
2和液态水,放出Q kJ的热量,请写出该反应的热化学方程式
N2H4(l)+2H2O2(l)=N2(g)+4H2O(l);△H=-2QkJ/mol
N2H4(l)+2H2O2(l)=N2(g)+4H2O(l);△H=-2QkJ/mol
;Y
2X
4还可以和Z
2构成清洁高效的燃料电池,若电解质溶液为NaOH溶液,则负极的电极反应式为
N2H4-4e-+4OH-=N2+4H2O
N2H4-4e-+4OH-=N2+4H2O
.


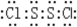
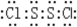


 NH3?H2O+H+
NH3?H2O+H+ NH3?H2O+H+
NH3?H2O+H+ H++HO2-HO2-
H++HO2-HO2- H++O22-
H++O22- H++HO2-HO2-
H++HO2-HO2- H++O22-
H++O22-

