海洋中有丰富的食品、矿产、能源、药物和水产资源,如图为海水利用的部分过程.
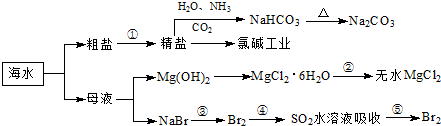
回答下列有关问题.
(1)下列有关说法正确的是
.
A.目前国际上主要使用蒸馏法的“海水淡化”技术,得高纯度淡水
B.用澄清的石灰水可鉴别NaHCO
3和Na
2CO
3C.在第③、④、⑤步骤中,溴元素均被氧化
D.工业上通过电解饱和NaCl溶液制取金属钠
(2)写出第③步骤的化学反应方程式
.
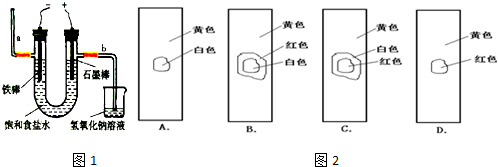
(3)工业上利用电解饱和食盐水可制得重要化工产品,又称为“氯碱工业”. 氯气的工业制取装置如图1,回答:
①若饱和食盐水中含有酚酞,通电后
(填a或b)侧先变红.
②电解反应的化学方程式为
.
③氯气制成氯水,用玻璃棒蘸取新制氯水滴在pH试纸中部,观察到的现象是
.
(4)工业上以NaCl、NH
3、CO
2等为原料先制得NaHCO
3,进而生产出纯碱.有关反应的化学方程式为:
NH
3+CO
2+H
2O═NH
4HCO
3;
NH
4HCO
3+NaCl═NaHCO
3↓+NH
4Cl;
2NaHCO
3Na
2CO
3+CO
2↑+H
2O
某活动小组根据上述制碱原理,进行碳酸氢钠的制备实验.
①一位同学将二氧化碳气体通入含氨的饱和食盐水中制备碳酸氢钠,实验装置如图3所示(图中夹持、固定用的仪器未画出).试回答下列有关问题:
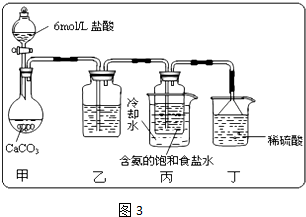
Ⅰ、乙装置中的试剂是
,其作用是
.
Ⅱ、丁装置中稀硫酸的作用是
.
Ⅲ、实验结束后,分离出NaHCO
3 晶体的操作是
(填分离操作的名称),该操作所需要的玻璃仪器有
.
②碳酸氢钠受热所得固体12.28g与足量的石灰水充分反应,所得沉淀经洗涤、干燥质量为12.00g,则所得固体中碳酸钠的质量分数为
.
③请你再设计出一种实验室制取少量碳酸氢钠的方法:
.



