
题目列表(包括答案和解析)
(8分)(1)在调水工程中,沿途工业污水的任意排放是造成水质恶化的最大原因。经检测某工厂废液中含有大量Mg2+、Al3+、Ag+,Fe3+、Ba2+。试分析回答下列问题:
①该废液中可能大量存在的一种阴离子是____(填序号)。
A.SO B.NO C.Cl- D.CO
②为了充分利用资源和保护环境,今要回收废液中的金属银,请你设计一个回收实验方案,并写出有关离子反应方程式: ____________________________________________
________________________________________________________________________。
(2)节能减排是中国政府报告中的关键词。火力发电厂为了减少二氧化硫的排放,往往对煤炭进行脱硫处理,而脱硫的方法有多种,下面是一种常用的脱硫方法:
微生物脱硫技术:煤炭中的硫是以FeS2存在的,在水和空气存在的条件下,脱硫微生物起生物催化作用:
①2FeS2+7O2+2H2O  4H++2Fe2++4SO42—;
4H++2Fe2++4SO42—;
②4Fe2++O2+4H+ 4Fe3++2H2O;
4Fe3++2H2O;
③FeS2+2Fe3+ 3Fe2++2S;
3Fe2++2S;
④2S+3O2+2H2O 4H++2SO42—。
4H++2SO42—。
在微生物脱硫的反应中,FeS2最终被________氧化,转化为________(填化学式)而除去;反应③中若生成0.2 mol S,则转移的电子为________mol。
(8分)碘化钠是实验室中常用的分析试剂,工业上用铁屑还原法制备NaI的流程如下图:
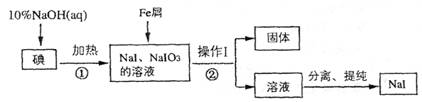
请回答下列问题:
(1)
判断反应①中碘是否反应完全的方法是_____________ ________
________
(2) 操作I的名称是_____________________;
(3) 反应①的离子方程式为_____________________
(4) 反应②中NaIO3被Fe单质还原为NaI,同时生成Fe(OH)3,该反应的化学方程式是______;
在该反应中若有99 g NaIO3被还原,则转移电子的物质的量为_______mol
(8分)工业甲醇的质量分数可以用下列方法测定:
①在稀H2SO4中甲醇被Cr2O72—氧化成CO2和H2O,反应式为:
CH3OH+Cr2O72—+8H+=CO2↑+2Cr3++6H2O;
②过量的Cr2O72—可用Fe2+与之完全反应:
_____Cr2O72—+_____Fe2++_____H+ —_____Cr3++______Fe3++______H2O
现有0.12 g工业甲醇,在H2SO4溶液中与25 mL 0.2 mol·L-1K2Cr2O7溶液反应,
多余的K2Cr2O7再用1 mol·L—1FeSO4与其反应,结果用去FeSO4溶液9.6 mL。
(1)配平第②步中离子方程式。
(2)计算工业甲醇的质量分数。
(8分,每空2分)工业上制取CuCl2的生产流程如下:

请结合下表数据,回答下列问题:
| 物 质 | Fe(OH)2 | Cu(OH)2 | Fe(OH)3 |
| 溶度积/25℃ | 8.0×10-16 | 2.2×10-20 | 4.0×10-38 |
| 完全沉淀时的pH范围 | ≥9.6 | ≥6.4 | 3~4 |
⑴ 溶液A中加入NaClO的目的是 ;
⑵ 在溶液B中加入CuO的作用是 ;
⑶ 操作a的目的是 ;
⑷ 在Cu(OH)2加入盐酸使Cu(OH)2转变为CuCl2。采用多量盐酸和低温蒸干的目的是 。
(8分)用:NaCl做原料可以得到多种产品。
(1)工业上由NaCI制备金属钠的化学方程式是 。
(2)实验室用惰性电极电解100mL 0.1mol/LNaCl溶液。写出阳极的电极反应方程式:
。
(3)某学生想制作一种家用环保型消毒液发生器,用石墨做电极电解饱和NaCl溶液。为使Cl 被完全吸收,制得有较强杀菌能力的消毒液(“84消毒液”),设计了如图的装置,则对电源电极名称和消毒液的主要成分判断正确的是
被完全吸收,制得有较强杀菌能力的消毒液(“84消毒液”),设计了如图的装置,则对电源电极名称和消毒液的主要成分判断正确的是

A.a为正极,b为负极;NaClO和NaCl
B.a为负极,b为正极;NaClO和NaCl
C.a为阳极,b为阴极;HClO和NaCl
D.a为阴极'b为阳极;HClO和NaCl
假设最后所得溶液中仅含一种溶质,则整个过程用一个化学方程式表示为:
。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com