
题目列表(包括答案和解析)
(15分)Ⅰ某研究性学习小组对过量炭粉与氧化铁反应的气体产物成分进行研究。
(1)提出假设:①该反应的气体产物是CO2。②该反应的气体产物是CO。③该反应的气体产物是 
(2)设计方案:如图所示,将一定量的氧化铁在隔绝空气的条件下与过量炭粉完全反应,测定参加反应的碳元素与氧元素的质量比。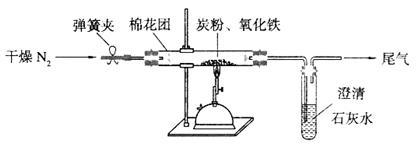
(3)查阅资料:氮气不与碳、氧化铁发生反应。实验室可以用氯化铵饱和溶液和亚硝酸钠(NaNO2)饱和溶液混合加热反应制得氮气。
①请写出该反应的离子方程式: 。
②下列装置可用于实验室制取氮气的是 。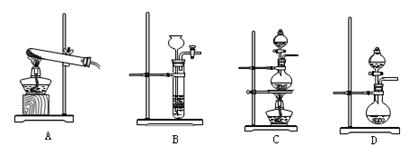
(4)实验操作及实验现象:
①按上图连接装置,并检查装置的气密性,称取3.20g氧化铁与2.00g炭粉混合均匀,放入48.48g的硬质玻璃管中;
②加热前,先通一段时间纯净干燥的氮气;
③停止通入N2后,夹紧弹簧夹,加热一段时间,澄清石灰水变浑浊;
④待反应结束,再通一段时间的氮气。冷却至室温,称得硬质玻璃管和固体总质量为52.24g。
(5)数据处理,经计算,参加反应的碳元素质量为0.48g,氧元素为0.96g。推断假设 成立。 该实验中发生的化学方程式为 。
该实验中发生的化学方程式为 。
(6)实验优化:根据实验得出的结论,应对该实验装置进一步完善,你认为应作如何改进? 。
Ⅱ由碳的氧化物直接合成甲醇、乙醇燃料已进入工业生产。如:
反应① CO(g)+2H2(g)  CH3OH(g)
CH3OH(g)
反应② 2CO(g)+4H2 (g) CH3CH2OH (g)+H2O (g)
CH3CH2OH (g)+H2O (g)
某同学为了寻找合成甲醇的适宜条件[温度、压强、碳氢比n(CO)/n(H2)、催化剂质量],设计了如下对比实验,部分实验条件已经填在下面实验设计表中(每次实验,反应时间相同)。
| 实验编号 | T(℃) | n (CO)/n(H2) | P(MPa) | CO转化率(%) |
| 1 | 150 | 1/3 | 0.1 | K^S*5U.C# |
| 2 | x | 1/3 | 5 | |
某研究性学习小组探究如下实验:在常温下,取两片质量相等、外形和组成相同且表面经过砂纸打磨完全去掉氧化膜的铝片,分别加入盛有相同体积、H+浓度相同的稀硫酸和稀盐酸的两支大小相同的试管中,发现铝片在稀盐酸中产生氢气的反应速率比在稀硫酸中的快。查阅相关资料后得知:化学反应速率主要由参加反应的物质的性质决定,其次是外界因素的影响。
(1)写出以上反应的离子方程式_______________________________。
(2)出现上述现象的原因可能:假设①SO42—对铝与H+的反应有抑制作用;假设②______________________________________。
(3)请设计实验对上述假设进行验证:
①____________________________________________;
②____________________________________________。
(4)如果上述假设都成立,要使上述稀硫酸与铝反应产生氢气的速率加快,可以采取的措施有:
①__________________________________________________;
②__________________________________________________;
③__________________________________________________;
④__________________________________________________。
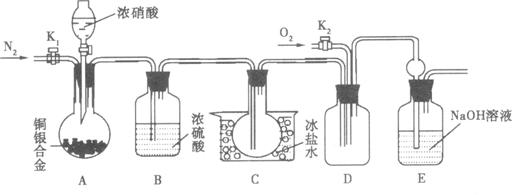
请回答下列问题:
(1)写出A瓶中铜与硝酸可能发生反应的化学方程式;______________________。
(2)实验开始前要先打开A部分的活塞K1,持续通一段时间的氮气再关闭K1,这
样做的目的是______________________________________________;装置中B瓶的作用是____________________________________________________________________。
(3)A中的反应停止后,打开D中的活塞K2,并通入氧气,若反应确有NO产生,则D中应出现的现象是__________________;实验发现,通入氧气温度的高低对实验现象有较大影响,为便于观察应通入___________(填“冷”或“热”)的氧气。
(4)已知合金的质量为a,且合金完全溶解。若还想测定铜的质量分数,只需利用A装置中反应后的溶液进行简单的实验操作就可以达到目的。请简述实验过程:_____________________。
| 名称 | 乙二酸 | 乙二酸晶体 |
| 分子式 | H2C2O4 | H2C2O4?2H2O |
| 颜色状态 | 无色固体 | 无色晶体 |
| 溶解度(g) | 8.6(20℃) | - |
| 熔点(℃) | 189.5 | 101.5 |
| 密度(g?cm-3) | 1.900 | 1.650 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com