
题目列表(包括答案和解析)
(06年广东卷)某可充电的锂离子电池以LiMn2O4为正极,嵌入锂的碳材料为负极,含Li+导电固体为电解质。放电时的电池反应为:Li+LiMn2O4==Li2Mn2O4。下列说法正确的是()
A.放电时,LiMn2O4发生氧化反应
B.放电时,正极反应为:Li++LiMn2O4+e-==Li2Mn2O4
C.充电时,LiMn2O4发生氧化反应
D.充电时,阳极反应为:Li++e-==Li

| 沉淀物 | Fe(OH)3 | Al(OH)3 | Mg(OH)2 |
| PH | 3.2 | 5.2 | 12.4 |
某工厂的废液经测定得知主要含有乙醇,其中还溶有丙酮、乙酸和乙酸乙酯。现欲从废液中回收乙醇和乙酸,根据各物质的沸点,补充下列实验步骤,模拟实现这一过程,并回答有关问题。
|
物质 |
丙酮( |
乙酸乙酯 |
乙醇 |
乙酸 |
|
沸点/℃ |
56.2 |
77.06 |
78 |
117.2 |
可供选择的实验用品:
1 mol·L-1烧碱溶液,18.4 mol·L-1硫酸,蒸馏水和冰,400 mL烧杯,250 mL烧杯,250 mL蒸馏烧瓶,温度计,冷凝器,接收器,玻璃棒以及中学化学实验的常用仪器。
(1)补充下列实验步骤:
①组装蒸馏装置,检查气密性;
②取100 mL废液注入250 mL蒸馏烧瓶中,滴入1 mol·L-1烧碱溶液,调至废液pH=10;
③________________________________________________________________________;
④________________________________________________________________________;
⑤________________________________________________________________________;
⑥________________________________________________________________________。
(2)滴入1 mol·L-1烧碱溶液,使溶液的pH=10的目的是
________________________________________________________________________。
(3)用18.4 mol·L-1硫酸的目的是(用化学方程式表示)
________________________________________________________________________。
(4)最后蒸馏烧瓶内残留液中的溶质的主要成分是________。
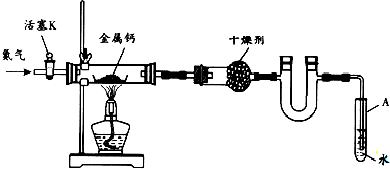
| 空瓷舟质量m0/g | 瓷舟与钙的质量m1/g | 瓷舟与产物的质量m2/g |
| 14.80 | 15.08 | 15.15 |
| 14 |
| 5 |
| 14 |
| 5 |
| n(Ca) |
| n(N) |
| 3 |
| 2 |
| n(Ca) |
| n(N) |
| 3 |
| 2 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com