
题目列表(包括答案和解析)
. 电镀厂曾采用有氰电镀工艺,处理有氰电镀的废水时,可在催化剂TiO2作用下,先用NaClO将CN-离子氧化成CNO-,再在酸性条件下继续被NaClO氧化成N2和CO2。环保工作人员在密闭系统中用下图装置进行实验,以证明处理方法的有效性,并通过测定二氧化碳的量确定CN-被处理的百分率。
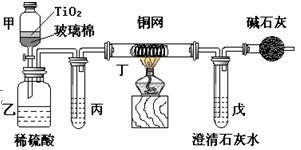
将浓缩后含CN-离子的污水与过量NaClO溶液的混合液共200 mL(其中CN-的浓度为0.05 mol·L-1)
倒入甲中,塞上橡皮塞,一段时间后,打开橡皮塞和活塞,使溶液全部放入乙中,关闭活塞。回答下列问题:
⑴ 甲中反应的离子方程式为 ,
乙中反应的离子方程式为 。
⑵ 乙中生成的气体除N2和CO2外,还有HCl及副产物Cl2等。丙中加入的除杂试剂是饱和食盐水,其作用是 ,
丁在实验中的作用是 ,
装有碱石灰的干燥管的作用是 。
⑶ 戊中盛有含Ca(OH)2 0.02mol的石灰水,若实验中戊中共生成0.82 g沉淀,则该实验中测得CN-被处理的百分率等于 。该测得值与工业实际处理的百分率相比总是偏低,简要说明可能的原因。① 。
② 。
请提出一个能提高准确度的建议(要有可操作性,且操作简单)
。
| |||||||||||||||
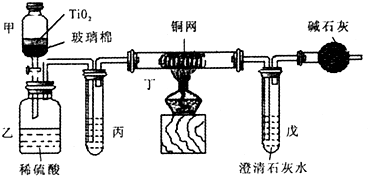
将浓缩后含CN -的污水与过量NaClO溶液的混合液共200 mL(其中CN -的浓度为0.05 mol· L-1)倒入甲中,塞上橡皮塞,一段时间后,打开橡皮塞和活塞,使溶液全部放入乙中,关闭活塞。回答下列问题:?
(1)甲中反应的离子方程式为 ,?
乙中反应的离子方程式为 。
(2)乙中生成的气体除N2和CO2外,还有HCl及副产物Cl2等,上述实验是通过测定二氧化碳的量来确定对CN-的处理效果。则丙中加入的除杂试剂是。 (填字母)?
a.饱和食盐水 b.饱和NaHCO3溶液? c.浓NaOH溶液 d.浓硫酸?
(3)丁在实验中的作用是 ,?
装有碱石灰的干燥管的作用是 。?
(4)戊中盛有含Ca(OH)2 0.02 mol的石灰水,若实验中戊中共生成0.82 g沉淀,则该实验中测得CN-被处理的百分率等于 。?
请说明该测得值与实际处理的百分率相比偏高还是偏低 ?简要说明可能的原因 。?
(5)请提出一个能提高准确度的建议(要有可操作性,不宜使操作变得过于复杂) 。
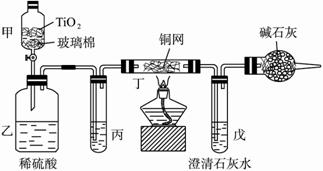
电镀厂曾采用有氰电镀工艺,由于排放的废水中含有的剧毒CN-离子,而逐渐被无氰电镀工艺替代。处理有氰电镀的废水时,可在催化剂TiO2作用下,先用NaClO将CN-离子氧化成CNO-,再在酸性条件下继续被NaClO氧化成N2和CO2。环保工作人员在密闭系统中用下图装置进行实验,以证明处理方法的有效性,并测定CN-被处理的百分率。
将浓缩后含CN-离子的污水与过量NaClO溶液的混合液200 mL(其中CN-的浓度为0.05 mol?L-1)倒入甲中,塞上橡皮塞,一段时间后,打开橡皮塞和活塞,使溶液全部放入乙中,关闭活塞。
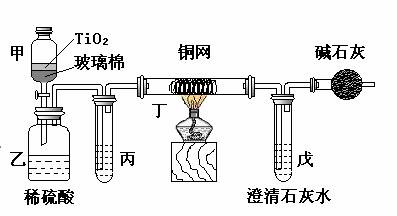
(1) 甲中反应的离子方程式为_______________;乙中反应的离子方程式为________
(2) 乙中生成的气体除N2和CO2外,还有HCl及副产物Cl2等,上述实验是通过测定二氧化碳的量来确定对CN-的处理效果。丙中加入的除杂试剂是____________(填字母)
a.饱和食盐水 b.饱和NaHCO3溶液
c.浓NaOH溶液 d.浓硫酸
(3)丁在实验中的作用是__________________________________
(4)戊中盛有足量的石灰水,若实验中戊中共生成0.82 g沉淀,则该实验中测得CN-被处理的百分率等于_________________。请说明该测得值与实际处理的百分率相比偏高还是偏低?简要说明理由______________________________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com