
题目列表(包括答案和解析)
已知25℃时弱电解质电离平衡常数:
Ka(CH3COOH) l.8 xl0-5,Ka(HSCN) 0.13
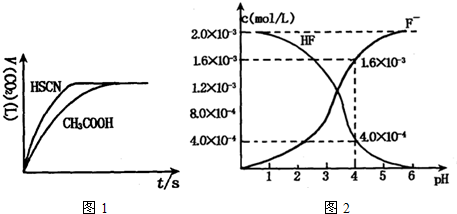
(1)将20mL,0.10mol/L CH3COOH溶液和20mL,0.10mol/L的HSCN溶液分别与0.10mol/L的NaHCO3溶液反应,实验测得产生CO2气体体积(V)与时间t的关系如图。
反应开始时,两种溶液产生CO2的速率明显不同的原因是 ;
反应结束后所得溶液中c(SCN-)____ c(CH3COO-)(填“>”,“=”或“<”)。
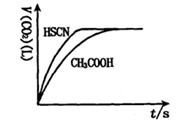
(2)2.0×l0-3mol/L的氢氟酸水溶液中,调节溶液pH(忽略调节时体积变化),测得平衡体系中c(F-),c(HF)与溶液pH的关系如下图。
则25℃时,HF电离平衡常数为:(列式求值)Ka(HF)=
(3)难溶物质CaF2溶度积常数为:Ksp= 1.5×10-10,将4.0×10-3mol/L HF溶液与4.0×l0-4 mol/L的CaCl2溶液等体积混合,调节溶液pH =4(忽略调节时溶液体积变化),试分析混合后是否有沉淀生成?____ (填“有”或“没有”),筒述理由: 。
已知25℃时弱电解质电离平衡常数:
Ka(CH3COOH) l.8 xl0-5,Ka(HSCN) 0.13
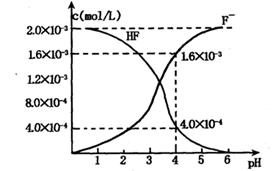
(1)将20mL,0.10mol/L CH3COOH溶液和20mL,0.10mol/L的HSCN溶液分别与0.10mol/L的NaHCO3溶液反应,实验测得产生CO2气体体积(V)与时间t的关系如图。
反应开始时,两种溶液产生CO2的速率明显不同的原因是 ;
反应结束后所得溶液中c(SCN-)____ c(CH3COO-)(填“>”,“=”或“<”)。
(2)2.0×l0-3mol/L的氢氟酸水溶液中,调节溶液pH(忽略调节时体积变化),测得平衡体系中c(F-),c(HF)与溶液pH的关系如下图。
则25℃时,HF电离平衡常数为:(列式求值)Ka(HF)=
(3)难溶物质CaF2溶度积常数为:Ksp= 1.5×10-10,将4.0×10-3mol/L HF溶液与4.0×l0-4 mol/L的CaCl2溶液等体积混合,调节溶液pH =4(忽略调节时溶液体积变化),试分析混合后是否有沉淀生成?____ (填“有”或“没有”),筒述理由: 。
在氧气中灼烧0.44克硫和铁组成的化合物,使其中硫全部氧化并转化为硫酸, 这些硫酸用
20ml,0.5moL.L-1NaOH溶液可以完全中和, 则原化合物中硫的质量分数为( )
A.13% B.46% C.36% D.53%
20ml,0.5moL.L-1NaOH溶液可以完全中和, 则原化合物中硫的质量分数为( )
A.13% B.46% C.36% D.53%
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com