
题目列表(包括答案和解析)

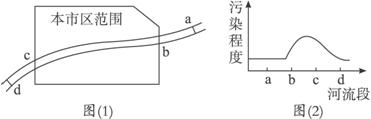
(1)造成X河污染的主要污染源最可能分布在( )
A.ab段 B.bc段 C.cd段 D.bd段
(2)列举造成X河污染的三种可能的污染源。
(3)对c处水样进行检测,发现其中含有Cu2+等重金属离子。若要把铜离子变为单质铜回收,请回答两种回收的方法:
方法Ⅰ:_____________________________,方法Ⅱ:________________________。
(4)d处污染程度明显降低,请从物理、化学、生物学三个方面简单分析其原因。
(10分)已知 2 mol SO2 (g) 氧化为2 mol SO3 (g) 的能量变化如图所示:
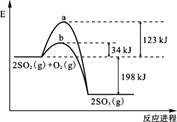
(1)写出SO2 (g) 氧化为SO3 (g) 的热化学方程式:
(2)氧化SO2时,工业上常加入V2O5作催化剂,其反应机理可表示为
SO2 + V2O5 = SO3 + 2VO2 , 4VO2 + O2 = 2V2O5 ;
上图中表示加入V2O5的反应曲线为 (填“a”或“b”)。
(3)若在容积为2 L的密闭容器中充入2 mol SO2 (g)和1 mol O2 (g),如图甲所示,经2 min达到平衡,测得放出热量为178.2 kJ,则:

①2 min内 O2的化学反应速率v(O2)= ;
②若再充入1 mol O2重新达到平衡时,SO3平衡浓度的取值范围是: 。
(4)若将2 mol SO2 (g)和1 mol O2 (g)充入容积可变的容器乙中,初始体积为2 L,达到平衡时放出热量Q kJ,则Q 178.2 kJ(填“>”,“=”或“<”)。
(10分)已知 2 mol SO2 (g) 氧化为2 mol SO3 (g) 的能量变化如图所示:
(1)写出SO2 (g) 氧化为SO3 (g) 的热化学方程式:
(2)氧化SO2时,工业上常加入V2O5作催化剂,其反应机理可表示为
SO2 + V2O5 = SO3 + 2VO2, 4VO2 + O2 = 2V2O5;
上图中表示加入V2O5的反应曲线为 (填“a”或“b”)。
(3)若在容积为2 L的密闭容器中充入2 mol SO2 (g)和1 mol O2 (g),如图甲所示,经2 min达到平衡,测得放出热量为178.2 kJ,则:
①2 min内 O2的化学反应速率v(O2)= ;
②若再充入1 mol O2重新达到平衡时,SO3平衡浓度的取值范围是: 。
(4)若将2 mol SO2 (g)和1 mol O2 (g)充入容积可变的容器乙中,初始体积为2 L,达到平衡时放出热量Q kJ,则Q 178.2 kJ(填“>”,“=”或“<”)。
同温同压下,两个等体积的干燥圆底烧瓶中分别充满①NH3、②NO2,进行喷泉实验,如图16所示,经充分反应后,瓶内溶液的物质的量浓度为( )
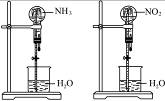
图1-6
A.①>② B.①<②
C.①=② D.不能确定
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com