
题目列表(包括答案和解析)
| 元素 | 有关信息 |
| X | 元素主要化合价为-2,原子半径为0.074nm |
| Y | 所在主族序数与所在周期序数之差为4 |
| Z | 原子半径为0.102nm,其单质在X的单质中燃烧,发出明亮的蓝紫色火焰 |
| D | 最高价氧化物对应的水化物,能电离出电子数相等的阴、阳离子 |
| E | 单质是生活中常见金属,其制品在潮湿空气中易被腐蚀或损坏 |
| ||
| ||
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |

有关元素X、Y、Z、D、E的信息如下
| 元素 | 有关信息 |
| X | 元素主要化合价为―2,原子半径为0.074nm |
| Y | 所在主族序数与所在周期序数之差为4 |
| Z | 原子半径为0.102nm,其单质在X的单质中燃烧,发出明亮的蓝紫色火焰 |
| D | 最高价氧化物对应的水化物,能电离出电子数相等的阴、阳离子 |
| E | 单质是生活中常见金属,其制品在潮湿空气中易被腐蚀或损坏 |
请回答下列问题:
(1)X的一种氢化物可用于实验室制取X的单质,其反应的化学方程式为 。
(2)E元素与Y元素可形成EY2和EY3两种化合物,下列说法正确的是(填序号) 。
①保存EY2溶液时,需向溶液中加入少量E单质
②EY2只能通过置换反应生成,EY3只能通过化合反应生成
③铜片、碳棒和EY3溶液组成原电池,电子由铜片沿导线流向碳棒
④向淀粉碘化钾溶液和苯酚溶液中分别滴加几滴EY3的浓溶液,原无色溶液都变成紫色
(3)用化学符号表示D2Z的水溶液中各粒子的浓度关系,如c(Z2-)= 。
|
溶液,两者恰好完全反应(已知反应过程
放热),生成物中有三种含Y元素的离子,
其中两种离子的物质的量(n)与反应时
间(t)的变化示意图如图所示。该苛性钾
溶液中KOH的质量是 ,该反
应中转移电子的物质的量是 。
有A、B、C、D、E五种元素,它们的原子序数由A至E渐大.D的氢化物的分子式为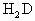 ;D的最高价氧化物中D的质量分数为40%,且D原子的原子核中质子数和中子数相等.A原子最外电子层有4个电子.B的阴离子与C的阳离子和氖原子的电子层结构相同.E原子的M电子层上共有7个电子.常温、常压下,B单质是气体,已知0.1mol的B单质与
;D的最高价氧化物中D的质量分数为40%,且D原子的原子核中质子数和中子数相等.A原子最外电子层有4个电子.B的阴离子与C的阳离子和氖原子的电子层结构相同.E原子的M电子层上共有7个电子.常温、常压下,B单质是气体,已知0.1mol的B单质与 完全反应需2.408×
完全反应需2.408×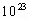 个氢原子.C单质在加热条件下与B单质反应生成淡黄色固体.根据上述情况,试回答下列各问题.
个氢原子.C单质在加热条件下与B单质反应生成淡黄色固体.根据上述情况,试回答下列各问题.
(1)A~E的元素符号分别为:________、________、________、________、________.
(2)C位于元素周期表中________周期、________族,其阳离子的结构示意图为________.
(3)D原子的电子式为________;E离子的符号为________.
(4)A元素与其余4种元素所能形成化合物的分子式为(仅限于由两元素组成)________、________、________、________.
(5)C单质和B单质在加热条件下生成化合物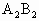 ,反应的化学方程式为________,反应中________为氧化剂;________为还原剂.
,反应的化学方程式为________,反应中________为氧化剂;________为还原剂.
(6)1.15g的C单质溶于50mL水中,所得溶液的质量分数为________.
 已知A、B、C、D、E五种元素的原子序数依次递增,A、B、C、D位于前三周期.A位于周期表的s区,其原子中电子层数和未成对电子数相同;B的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同;D原子的核外成对电子数是未成对电子数的3倍.A、B、D三种元素组成的一种化合物M是新装修居室中常含有的一种有害气体,A、B二种元素组成的原子个数比为1:1的化合物N是常见的有机溶剂.E有“生物金属”之称,E4+离子和氩原子的核外电子排布相同.
已知A、B、C、D、E五种元素的原子序数依次递增,A、B、C、D位于前三周期.A位于周期表的s区,其原子中电子层数和未成对电子数相同;B的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同;D原子的核外成对电子数是未成对电子数的3倍.A、B、D三种元素组成的一种化合物M是新装修居室中常含有的一种有害气体,A、B二种元素组成的原子个数比为1:1的化合物N是常见的有机溶剂.E有“生物金属”之称,E4+离子和氩原子的核外电子排布相同.已知A、B、C、D、E五种元素的原子序数依次递增,A、B、C、D位于前三周期。A位于周期表的s区,其原子中电子层数和未成对电子数相同;B的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同;D原子的核外成对电子数是未成对电子数的3倍。A、B、D三种元素组成的一种化合物M是新装修居室中常含有的一种有害气体,A、B二种元素组成的原子个数比为1:1的化合物N是常见的有机溶剂。E有“生物金属”之称,E![]() 离子和氩原子的核外电子排布相同。
离子和氩原子的核外电子排布相同。
请回答下列问题:(答题时,A、B、C、D、E用所对应的元素符号表示)
(1)E的基态原子的外围电子排布式为 。
 (2)下列叙述正确的是 。(填字母)
(2)下列叙述正确的是 。(填字母)
a.M与水分子间能形成氢键,N是非极性分子
b.M和二氧化碳分子中的中心原子均采用sp2杂化
c.N分子中含有6个![]() 键和1个
键和1个![]() 键
键
d.BD2晶体的熔点、沸点都比二氧化硅晶体的低
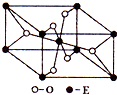
(3)E的一种氧化物Q,其晶胞结构如右上图所示,则Q的化学式为 ,该晶体中氧的配位数为 。
(4)电镀厂排放的废水中常含有剧毒的BC![]() 离子,可在Q的催化下,先用NaClO将 BC
离子,可在Q的催化下,先用NaClO将 BC![]() 氧化成BCD
氧化成BCD![]() ,再在酸性条件下BCD
,再在酸性条件下BCD![]() 继续被NaClO氧化成C2和BD2。
继续被NaClO氧化成C2和BD2。
① A、B、C、D四种元素的电负性由小到大的顺序为 。
② 与BCD![]() 互为等电子体的分子、离子的化学式依次为 (各写1种)。
互为等电子体的分子、离子的化学式依次为 (各写1种)。
③ 上述反应中后一步反应的离子方程式是 。
(5)在浓的ECl3的盐酸溶液中加入乙醚,并通入HCl至饱和,可得到配位数为6、组成为ECl3?6H20的绿色晶体,该晶体中两舞更体的物质的量之比为1:5,则该配离子的化学式为 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com