
题目列表(包括答案和解析)
已知铜和浓硫酸可以在加热条件下发生如下反应(反应方程式已配平):
Cu+2H2SO4(浓)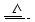 CuSO4+A↑+2H2O
CuSO4+A↑+2H2O
试通过计算和推理完成下面的问题:
(1)A物质可以导致酸雨的形成。则A应该属于 (用字母代号填写)
A.酸 B.碱 C.盐 D.酸性氧化物 E.碱性氧化物
A物质可以使酸性KMnO4溶液褪色,此反应中 (填写化学式,下同)失去电子,氧化剂是 。
(2)若A物质通入品红溶液,观察到溶液褪色,说明A物质具有 (填序号,下同);若A物质通入Na2S溶液,观察到溶液中出现淡黄色浑浊,说明SO2具有 。
A.氧化性 B.还原性 C.漂白性
若A物质通入双氧水,请大胆判断所得溶液是 (填溶质的化学式)
(3)一定量的铜片与100mL 18mol/L 的浓H2SO4充分反应,如果该反应过程中转移了0.2mol电子,生成的A气体在标准状况下体积为 L (假设气体全部逸出)。若用4 mol·L-1的NaOH溶液吸收生成的A,并生成正盐,写出发生的反应方程式 计算需要NaOH溶液的体积 L。
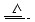 CuSO4+A↑+2H2O
CuSO4+A↑+2H2O过氧化氢(H2O2)俗称双氧水,不稳定,易分解。溶液的酸碱性对H2O2的稳定性有较大影响,如在碱性溶液中,H2O2分解较快。另外,H2O2见光、遇热、遇到大多数金属氧化物分解也会加快。以下装置可用于探究H2O2相关的性质。

请回答:
(1)实验室用MnO2作催化剂分解H2O2制取氧气,反应的化学方程式为 。
使用图1装置时,H2O2应该盛放在 (填“锥形瓶”或“分液漏斗”)中,读取氧气体积时要注意 。
(2)取等物质的量浓度等体积H2O2溶液分别进行下列实验,研究外界条件对该反应速率的影响,实验报告如下表所示。

①实验1、2研究的是 对H2O2分解速率的影响。
②实验2、3的目的是 。
(3)用 (填“酸式”或“碱式”)滴定管量取25.00mL H2O2溶液于图II的烧瓶中,滴入过量KMnO4酸性溶液反应,最终收集到56mLO2(已折算为标准状况),则该H2O2溶液的物质的量浓度为 。
(已知:2KMnO4+5H2O2+3H2SO4=2MnSO4+K2SO4+5O2↑+8H2O)你认为测得的数值比理论值
(填“偏高”、“偏低”或“相等”)
(4)实验表明Na2O2与水反应也可生成O2。某同学猜想是Na2O2先与H2O反应生成H2O2,然后H2O2分解产生O2。为此做探究如下:取Na2O2样品(杂质不参与反应)与过量水充分反应的少量X溶液于试管中,滴加FeCl2溶液,立即生成红褐色沉淀,该反应的离子方程式是 。
过氧化氢(H2O2)俗称双氧水,不稳定,易分解。溶液的酸碱性对H2O2的稳定性有较大影响,如在碱性溶液中,H2O2分解较快。另外,H2O2见光、遇热、遇到大多数金属氧化物分解也会加快。以下装置可用于探究H2O2相关的性质。
请回答:
(1)实验室用MnO2作催化剂分解H2O2制取氧气,反应的化学方程式为 。
使用图1装置时,H2O2应该盛放在 (填“锥形瓶”或“分液漏斗”)中,读取氧气体积时要注意 。
(2)取等物质的量浓度等体积H2O2溶液分别进行下列实验,研究外界条件对该反应速率的影响,实验报告如下表所示。
①实验1、2研究的是 对H2O2分解速率的影响。
②实验2、3的目的是 。
(3)用 (填“酸式”或“碱式”)滴定管量取25.00mL H2O2溶液于图II的烧瓶中,滴入过量KMnO4酸性溶液反应,最终收集到56mLO2(已折算为标准状况),则该H2O2溶液的物质的量浓度为 。
(已知:2KMnO4+5H2O2+3H2SO4=2MnSO4+K2SO4+5O2↑+8H2O)你认为测得的数值比理论值
(填“偏高”、“偏低”或“相等”)
(4)实验表明Na2O2与水反应也可生成O2。某同学猜想是Na2O2先与H2O反应生成H2O2,然后H2O2分解产生O2。为此做探究如下:取Na2O2样品(杂质不参与反应)与过量水充分反应的少量X溶液于试管中,滴加FeCl2溶液,立即生成红褐色沉淀,该反应的离子方程式是 。
过氧化氢(H2O2)俗称双氧水,不稳定,易分解。溶液的酸碱性对H2O2的稳定性有较大影响,如在碱性溶液中,H2O2分解较快。另外,H2O2见光、遇热、遇到大多数金属氧化物分解也会加快。以下装置可用于探究H2O2相关的性质。
请回答:
(1)实验室用MnO2作催化剂分解H2O2制取氧气,反应的化学方程式为 。
使用图1装置时,H2O2应该盛放在 (填“锥形瓶”或“分液漏斗”)中,读取氧气体积时要注意 。
(2)取等物质的量浓度等体积H2O2溶液分别进行下列实验,研究外界条件对该反应速率的影响,实验报告如下表所示。
①实验1、2研究的是 对H2O2分解速率的影响。
②实验2、3的目的是 。
(3)用 (填“酸式”或“碱式”)滴定管量取25.00mL H2O2溶液于图II的烧瓶中,滴入过量KMnO4酸性溶液反应,最终收集到56mLO2(已折算为标准状况),则该H2O2溶液的物质的量浓度为 。
(已知:2KMnO4+5H2O2+3H2SO4=2MnSO4+K2SO4+5O2↑+8H2O)你认为测得的数值比理论值
(填“偏高”、“偏低”或“相等”)
(4)实验表明Na2O2与水反应也可生成O2。某同学猜想是Na2O2先与H2O反应生成H2O2,然后H2O2分解产生O2。为此做探究如下:取Na2O2样品(杂质不参与反应)与过量水充分反应的少量X溶液于试管中,滴加FeCl2溶液,立即生成红褐色沉淀,该反应的离子方程式是 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com