
题目列表(包括答案和解析)
下图是中学教材中元素周期表的一部分,试回答下列问题:
|
① |
|
|
|
|
||||||||||||||||||||
|
|
|
|
|
② |
③ |
④ |
⑤ |
|
|
|||||||||||||||
|
⑥ |
|
|
|
|
|
|
|
|
|
|
|
⑦ |
⑧ |
|
⑨ |
⑩ |
11 |
|||||||
|
12 |
|
|
|
|
|
|
|
|
|
|
|
|
13 |
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
14 |
|
|
15 |
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
(1)在上表所列出的短周期元素中(填具体物质化学式)
①性质 最不活泼的是 ;
②原子半径最小的是(除稀有气体元素) _ 。简单阴离子半径最大的是 。
③形成的气态氢化物最稳定的是 ;
④最高价氧化物对应的水化物酸性最强的是 ,
⑤在⑤⑩15三种元素形成的阴离子中还原性最强的是 ,
⑥可作半导体的是 (填表中编号)
(2)用电子式表示②与④形成的化合物的形成过程 __。
(3)⑨与12形成的化合物溶于水所克服的微粒间作用力为 。
(4)13在元素周期表中的位置是 ,元素③形成的单质的结构式为 。
(5)________(填化学式)的单质既可以和盐酸又可以和氢氧化钠溶液反应,其单质与氢氧化钠溶液反应的离子方程式是___________________________________________。
(6) “神舟”六号载人飞船内需要有一种化合物来吸收航天员呼出的CO2,你认为该物质应该是由上表中的___ _(填表中编号)元素组成的,用化学方程式表示吸收原理:_________________ ______ 。
(7)设②的原子序数为Z,则14的原子序数为 (用Z表示)。
考查知识点:根据元素周期表,①比较金属性,非金属性,对应粒子还原性及半径的大小;②判断元素在周期表的位置;③化学键 ④位置确定序数;⑤位置推测用途
(10分)下图是元素周期表短周期中11种元素的化台价与原子序数的关系示意图,请回答下列问题(用具体的元素符号作答):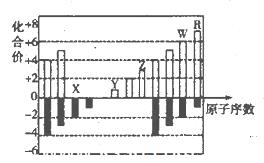
(1)元素x、Y、z、W、R五种元素中属于金属元素的是___________;Z的简单离子的结构示意图是___________。
(2)由此图可以判断,11种元素中处于同主族的共有____________组。
(3)X、Y.Z三种元素的原子半径大小顺序为___________;它们的离子的半径大小顺序为____________。

(12分)短周期元素A、B、C、D、E的原子序数依次增大,其元素特征信息如下表:
| 元素编号 | 元素特征信息 |
| A | 最高正价和最低负价的绝对值之差为2 |
| B | 最外层电子数是内层电子数的3倍 |
| C | 1molC单质能与冷水反应,在标准状况下生成11.2LH2 |
| D | 原子最外层电子数等于其周期序数 |
| E | 负二价阴离子的电子层结构与Ar原子相同 |
(1)E的简单离子的结构示意图为____________;
(2) D在周期表中的位置为________________;
(3)B和C简单离子的半径大小为__________;(用离子符号和“>”、“=”或“<”表示)
(4)元素非金属性强弱比较有很多方法,其中B和E的非金属性强弱的研究方案中不可行的是_________(填序号);
a.比较两种单质的颜色
b.比较氢化物的稳定性
c.依据两元素在周期表中的位置
d.依据两元素单质在自然界中的存在状态
(5)B元素均可与另外四种元素中的一种形成化合物,其中只含离子键的是___________(写化学式,下同),既含离子键又含共价键的是______________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com