
题目列表(包括答案和解析)
(15分)砷(As)在地壳中含量不大,但砷的化合物却是丰富多彩.
(1)基态砷原子的电子排布式为_______________,砷与溴的第一电离能较大的是______.
(2)AsH3是无色稍有大蒜味气体.AsH3的沸点高于PH3,其主要原因是
________________________________________________.
(3)Na3AsO4可作杀虫剂.AsO43-的空间构型为_____________,与其互为
等电子体的一种分子为______________.
(4)某砷的氧化物俗称“砒霜”,其分子结构如图所示,该化合物的分子式为__________,As原子采取_______杂化.

(5)GaAs等是人工合成的新型半导体材料,其晶体结构与金刚石相似。GaAs晶体中,每个As与_______个Ga相连,As与Ga之间存在的化学键有_____________(填字母)。
A.离子键 B.氢键 C.配位键 D.金属键 E.极性键
已知33As、35Br位于同一周期。某反应中反应物与生成物有:AsH3、H2SO4、KBrO3、K2SO4、H3AsO4、H2O和一种未知物质X。
(1)已知KBrO3在反应中得到电子,则该反应的还原剂是 。已知0.2mol KBrO3在反应中得到1mol电子生成X,则X的化学式是 。
(2)在该反应条件下可推知 (填序号)。
a.氧化性:KBrO3>H3AsO4 b.氧化性:H3AsO4>KBrO3
c.还原性:AsH3>X d.还原性:X>AsH3
(3)该反应的氧化剂和还原剂的物质的量之比为__________; KBrO3与HBr反应也会生成X,则该反应中氧化剂和还原剂的物质的量之比为__________。
砷(As)在地壳中含量不大,但砷的化合物却是丰富多彩.
(1)基态砷原子的电子排布式为________;砷与溴的第一电离能较大的是________.
(2)AsH3是无色稍有大蒜味气体.A sH3的沸点高于PH3,其主要原因是________.
(3)Na3AsO4可作杀虫剂.AsO43-的空间构型为________,与其互为等电子体的一种分子为________.
(4)某砷的氧化物俗称“砒霜”,其分子结构如图所示.该化合物的分子式为________,As原子采取________杂化.
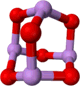
(5)GaAs等是人工合成的新型半导体材料,其晶体结构与金刚石相似.GaAs晶体中,每个As与________个Ga相连,As与Ga之间存在的化学键有________(填字母).
A.离子键
B.σ键
C.π键
D.氢键
E.配位键
F.金属键
G.极性键
| 元素 | 相关信息 |
| X | 组成蛋白质的基础元素,其最高正化合价与最低负化合价的代数和为2 |
| Y | 地壳中含量最高的元素 |
| Z | 存在质量数为23,中子数为11的核素 |
| W | 生活中大量使用其合金制品,工业上可用电解熔融氧化物的方法制备其单质 |
| R | 有多种化合价,其白色氢氧化物在空气中会迅速变成灰绿色,最后变成红褐色 |




湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com