
题目列表(包括答案和解析)
下列图示与对应的叙述一定正确的是 ( )
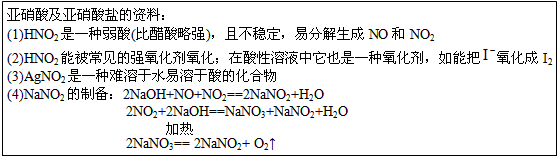
A.图1所示,反应:X(g)+2Y(g)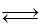 3Z(g),b的压强一定比a大
3Z(g),b的压强一定比a大
B.图2表明合成氨反应是放热反应,b表示在反应体系中加入了催化剂
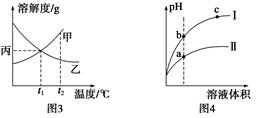
C.图3所示,t1℃时质量分数均为20%的甲、乙两种溶液,升温到t2℃时,两种溶液的溶质的质量分数仍然相等
D.图4所示,用水稀释pH相同的盐酸和醋酸,I表示醋酸,II表示盐酸,且溶液导电性:c>b>a
下列图示与对应的叙述一定正确的是( )


A.图1所示,反应:X(g)+2Y(g)  3Z(g),b的压强一定比a大
3Z(g),b的压强一定比a大
B.图2表明合成氨反应是放热反应,b表示在反应体系中加入了催化剂
C.图3所示,t1 ℃时质量分数均为20%的甲、乙两种溶液,升温到t2 ℃时,两种溶液中溶质的质量分数仍然相等
D.图4所示,用水稀释pH相同的盐酸和醋酸,Ⅰ表示醋酸,Ⅱ表示盐酸,且溶液导电性:c>b>a
A.图1所示,反应:X(g)+2Y(g)  3Z(g),b的压强一定比a大 3Z(g),b的压强一定比a大 |
| B.图2表明合成氨反应是放热反应,b表示在反应体系中加入了催化剂 |
| C.图3所示,t1℃时质量分数均为20%的甲、乙两种溶液,升温到t2℃时,两种溶液中溶质的质量分数仍然相等 |
| D.图4所示,用水稀释pH相同的盐酸和醋酸,Ⅰ表示醋酸,Ⅱ表示盐酸,且溶液导电性:c>b>a |
下列图示与对应的叙述一定正确的是 ( )
A.图1所示,反应:X(g)+2Y(g) 3Z(g),b的压强一定比a大
3Z(g),b的压强一定比a大
B.图2表明合成氨反应是放热反应,b表示在反应体系中加入了催化剂
C.图3所示,t1℃时质量分数均为20%的甲、乙两种溶液,升温到t2℃时,两种溶液的溶质的质量分数仍然相等
D.图4所示,用水稀释pH相同的盐酸和醋酸,I表示醋酸,II表示盐酸,且溶液导电性:c>b>a
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com